题目内容
7.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法错误的是( )
| A. | 元素X的单质是一种常见的半导体材料 | |
| B. | M和Y的最高价氧化物对应的水化物之间能互相反应 | |
| C. | Y的最高价氧化物对应水化物的酸性比X 的弱 | |
| D. | Z的气态氢化物比Y的气态氢化物稳定 |
分析 由四种短周期元素在周期表中的位置,可知M为第三周期元素,且只有M为金属元素,则M为Al,结合位置可知X为Si,Y为N,Z为O,
A.Si位于金属与非金属元素的交界处;
B.M和Y的最高价氧化物对应的水化物分别为氢氧化铝、硝酸;
C.非金属性越强,对应最高价氧化物的水化物的酸性越强;
D.非金属性越强,对应氢化物越稳定.
解答 解:由四种短周期元素在周期表中的位置,可知M为第三周期元素,且只有M为金属元素,则M为Al,结合位置可知X为Si,Y为N,Z为O,
A.Si位于金属与非金属元素的交界处,则元素X的单质是一种常见的半导体材料,故A正确;
B.M和Y的最高价氧化物对应的水化物分别为氢氧化铝、硝酸,二者可发生复分解反应生成盐和水,故B正确;
C.非金属性N>Si,Y的最高价氧化物对应水化物的酸性比X 的强,故C错误;
D.非金属性O>N,Z的气态氢化物比Y的气态氢化物稳定,故D正确;
故选C.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列化学用语正确的是( )
| A. | CCl4的电子式: | B. | Na2S的形成过程: | ||
| C. | CO2分子的电子式: | D. | 过氧化氢分子的结构式:H-O-O-H |
3.某化学兴趣小组制备硫化亚铁并探究其自燃性质.
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
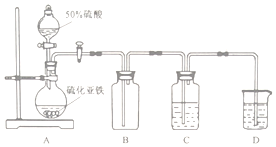
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
①表中x=60.50
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.

(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
15.某科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料,与电 解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2$?_{放电}^{充电}$4Li+2SOCl2,下列说法正确的是( )
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 放电时负极反应式为:Li-e-+Cl-=LiCl | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
2.下列实验操作及预期结果均正确的是( )
| 选项 | 实验操作 | 预期结果 |
| A | 将湿润的NH3通过盛有无水CaCl2的干燥管 | 可得到干燥的NH3 |
| B | 将乙烯、乙醇蒸气分别通入酸性KMnO4溶液中 | 两者均能使KMnO4溶液褪色 |
| C | Na2O2与湿润的红色石蕊试纸接触 | 试纸只变蓝不褪色 |
| D | 将CO2通入CaCl2溶液中 | 可得到白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
12.在标准状况下,100mL某气体的质量是0.125g,该气体的分子式可能是( )
| A. | NH3 | B. | CO | C. | H2S | D. | SO2 |
19.有A、B两种气体,在相同温度、相同压强下,当它们的质量比为2:1时,其体积比为3:2,则A、B的摩尔质量之比为( )
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 4:3 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在标准情况下,22.4L CH4与18gH2O含有的分子数均为NA | |
| B. | 0.1mol•L-1的FeCl3溶液中含有Fe3+的数目小于0.1NA | |
| C. | 0.1molNa2O2中含有的阴离子的数目为0.2NA | |
| D. | 0.1mol铁粉与足量水蒸气在高温下反应,生成的H2分子数为0.15NA |
17.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n,下列说法不正确的是( )
| A. | 若8>m>3,则X必定为P区元素 | |
| B. | 若Y的气态氢化物化学式为YHn,且b<4,则该氢化物一定为极性分子 | |
| C. | 若a=b=3,8>m>n>b,则元素非金属性:X>Y | |
| D. | 若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |