题目内容
18.氨的催化氧化法是工业生产中制取硝酸的主要途径,以下为其中的一步重要反应:4H3(g)+5O2(g)?4NO(g)+6H2O(g)
下列条件下,反应速率最快的是( )
| 选项 | 温度 | 催化剂 | NH3(g)浓度 |
| A | 500℃ | 铂金合金网 | 2mol/L |
| B | 500℃ | 无 | 1mol/L |
| C | 800℃ | 铂铑合金网 | 2mol/L |
| D | 800℃ | 铂铑合金网 | 1mol/L |
| A. | A | B. | B | C. | C | D. | D |
分析 一般来说,温度越高、浓度越大,加入催化剂,都可增大反应速率,以此解答该题.
解答 解:A、B与C、D相比较,C、D温度较高,且加入催化剂,则反应速率较大,C与D相比较,C浓度较大,则反应速率较大,
故选C.
点评 本题考查影响化学反应速率的因素,为高频考点,侧重考查学生的分析能力,注意把握影响化学反应速率的因素,注重基础知识的考查,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
8.下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 由水电离出的c(OH-)=1×10-12mol/L的溶液中:Na+、Mg2+、SO42-、Cl- | |
| B. | 能使甲基橙由橙色变为红色的溶液中:Cu2+、Al3+、NO3-、Br- | |
| C. | 加入Zn 能放出H2的溶液中:K+、Ba2+、Cl-、AlO2- | |
| D. | pH=12的溶液中:Ba2+、NH4+、NO3-、Cl- |
9.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 1mol甲基的电子数目为10NA |
6.X、Y、Z、W是四种金属单质,把X浸入Z的硝酸盐溶液中,X的表面有Z析出;X、Y和稀硫酸组成原电池时,X电极上有气泡生成;Z、W相连接后放入稀硫酸中,电子由Z流向W.X、Y、Z三种金属的活动性顺序为( )
| A. | Y>X>Z>W | B. | W>X>Z>Y | C. | X>Y>Z>W | D. | Y>Z>X>W |
13.某元素X最高价含氧酸的化学式为HnXO2n-2,则在其气态氢化物中X元素的化合价为( )
| A. | -(12-3n) | B. | -(3n-12) | C. | -(3n-4) | D. | -(n-10) |
3.某化学兴趣小组制备硫化亚铁并探究其自燃性质.
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
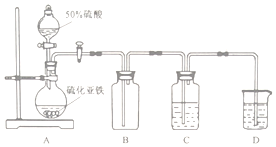
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
①表中x=60.50
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.

(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
5.磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品.已知:1mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3mol、2mol、1mol.下列推断正确的是( )
| A. | 磷酸与氢氧化钠反应能生成2种盐 | |
| B. | NaH2PO4、NaH2PO3、NaH2PO2都是酸式盐 | |
| C. | H3PO4、H3PO3、H3PO2都是含氧酸 | |
| D. | H3PO3是三元酸,又是还原性酸 |
2.下列实验操作及预期结果均正确的是( )
| 选项 | 实验操作 | 预期结果 |
| A | 将湿润的NH3通过盛有无水CaCl2的干燥管 | 可得到干燥的NH3 |
| B | 将乙烯、乙醇蒸气分别通入酸性KMnO4溶液中 | 两者均能使KMnO4溶液褪色 |
| C | Na2O2与湿润的红色石蕊试纸接触 | 试纸只变蓝不褪色 |
| D | 将CO2通入CaCl2溶液中 | 可得到白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |