题目内容
10.下列对初中化学知识的总结,错误的是( )| A. | 化学基本反应类型包括化合反应、分解反应、置换反应和复分解反应四种 | |
| B. | 六大基本营养素是蛋白质、糖类、油脂、维生素、无机盐和水 | |
| C. | 由同种元素组成的物质一定是纯净物 | |
| D. | 遇到火灾时,用湿毛巾捂住口鼻,匍匐逃离火灾现场 |
分析 A.化学基本反应类型包括化合反应、分解反应、置换反应和复分解反应;
B.由基本营养素的组成判断;
C.同种元素可能形成多种不同的单质;
D.用湿毛巾捂住口鼻,可以防止吸入浓烟.
解答 解:A.化学基本反应类型包括化合反应、分解反应、置换反应和复分解反应,共四种反应类型,故A正确;
B.六大基本营养素是蛋白质、糖类、油脂、维生素、无机盐和水,它们都是人类必需的基本营养物质,故B正确;
C.同种元素可能形成多种不同的单质,如碳的单质有金刚石、石墨等,金刚石、石墨属于不同的物质,混合在一起属于混合物,故C错误;
D.发生火灾时,会产生大量的浓烟,会使人窒息,用湿毛巾捂住口鼻,可以防止吸入浓烟,故D正确.
故选C.
点评 本题考查的知识点较综合,主要涉及化学基本反应类型、六大基本营养素、混合物、化学与安全,题目难度不大,侧重于考查学生对化学知识的理解和应用能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
5.下列能级的能量大小比较,正确的是( )
| A. | E(4s)>E(3d) | B. | E(6p)>E(5f) | C. | E(6s)<E(5p) | D. | E(4d)<E(5p) |
6.X、Y、Z、W是四种金属单质,把X浸入Z的硝酸盐溶液中,X的表面有Z析出;X、Y和稀硫酸组成原电池时,X电极上有气泡生成;Z、W相连接后放入稀硫酸中,电子由Z流向W.X、Y、Z三种金属的活动性顺序为( )
| A. | Y>X>Z>W | B. | W>X>Z>Y | C. | X>Y>Z>W | D. | Y>Z>X>W |
3.某化学兴趣小组制备硫化亚铁并探究其自燃性质.
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.
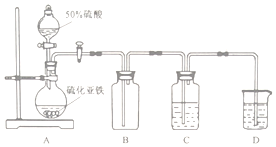
(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
①表中x=60.50
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
实验I 在石棉网上把研细的硫粉和铁粉按一定比例混合均匀,用灼热的玻璃棒触及混合物,当混合物呈红热状态时,移开玻璃棒,得到黑色FeS.
(1)玻璃棒的作用是加热引发铁与硫发生反应.
(2)常温下,该实验制得的硫化亚铁不能(填“能”或“不能”)自燃.
实验II 将H2S气体长时间通入硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中进行硫化,制备硫化亚铁.装置示意图如下.

(3)B装置的作用是缓冲瓶(或安全瓶).
(4)C中反应生成硫化亚铁的离子方程式为H2S+Fe2+=FeS↓+2H+
(5)C中的固液混合物经过滤、洗涤、干燥得到产品.检验过滤所得固体物质是否洗涤干净的方法是取少量洗涤液,滴加氯化钡溶液,茗无白色浑浊,则已经洗净.
(6)产品分析结果表:
| 硫质量分数/% | 总铁质量分数/% | 亚铁质量分数/% | 硫化亚铁质量分数/% |
| 22.00 | 44.60 | 38.50 | x |
②总铁质世分数大于亚铁质量分数,原因是产品中含有三价铁杂质
(7)制得的硫化亚铁在常温下能发生缓慢氧化而自燃,写出该过程的化学方程式:4FeS+7O2=2Fe2O3+4SO2(写一个).
5.磷酸(H3PO4)、亚磷酸(H3PO3)和次磷酸(H3PO2)都是重要的化工产品.已知:1mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3mol、2mol、1mol.下列推断正确的是( )
| A. | 磷酸与氢氧化钠反应能生成2种盐 | |
| B. | NaH2PO4、NaH2PO3、NaH2PO2都是酸式盐 | |
| C. | H3PO4、H3PO3、H3PO2都是含氧酸 | |
| D. | H3PO3是三元酸,又是还原性酸 |
15.某科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半.他们把锂锰氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料,与电 解质和正极材料(石墨)构成可充电电池.若电解液为LiAlCl4-SOCl2,电池的总反应为:4LiCl+S+SO2$?_{放电}^{充电}$4Li+2SOCl2,下列说法正确的是( )
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 放电时负极反应式为:Li-e-+Cl-=LiCl | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
2.下列实验操作及预期结果均正确的是( )
| 选项 | 实验操作 | 预期结果 |
| A | 将湿润的NH3通过盛有无水CaCl2的干燥管 | 可得到干燥的NH3 |
| B | 将乙烯、乙醇蒸气分别通入酸性KMnO4溶液中 | 两者均能使KMnO4溶液褪色 |
| C | Na2O2与湿润的红色石蕊试纸接触 | 试纸只变蓝不褪色 |
| D | 将CO2通入CaCl2溶液中 | 可得到白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
19.有A、B两种气体,在相同温度、相同压强下,当它们的质量比为2:1时,其体积比为3:2,则A、B的摩尔质量之比为( )
| A. | 1:2 | B. | 2:1 | C. | 2:3 | D. | 4:3 |
20.下列各溶液中,有关成分的物质的量浓度关系正确的是( )
| A. | 10 mL 0.5 mol•L-1 CH3COONa 溶液与 6 mL1 mol•L-1 盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1pH 为 4 的 NaHB 溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | pH 相等的(NH4)2SO4、(NH4)2Fe(SO4)2和 NH4Cl 溶液中:c[(NH4)2SO4]>c[(NH4)2Fe(SO4)2]>c(NH4Cl) |