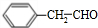题目内容
8.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
分析 由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)同周期自左而右非金属性增强,非金属越强,最高价氧化物对应水化物的酸性越强,氧元素、氟元素不存在最高价含氧酸;
(3)铝元素氧化物--氧化铝属于两性氧化物,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(4)Na元素焰色反应为黄色;
(5)⑥的最高价氧化物为二氧化硅,与烧碱溶液反应生成硅酸钠与水;
(6)Na和O形成的稳定化合物为Na2O2,与CO2反应生成碳酸钠与氧气.
解答 解:由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,
故答案为:Ar;
(2)氧元素、氟元素不存在最高价含氧酸,第二周期中除O、F外,N元素非金属性最强,故HNO3的酸性最强,
故答案为:HNO3;
(3)铝元素氧化物--氧化铝属于两性氧化物,铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)④元素与⑧元素形成的化合物为NaCl,含有钠元素,高温灼烧时,火焰呈黄色,
故答案为:黄;
(5)⑥的最高价氧化物为二氧化硅,与烧碱溶液反应生成硅酸钠与水,反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(6)Na和O形成的稳定化合物为Na2O2,与CO2反应生成碳酸钠与氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查元素周期表、元素周期律、元素化合物知识等,侧重对化学用语的考查,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2溶液 | H2SO4溶液 | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:Cl-<Br-<I- | ||
| C. | 酸性:H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
| A. | CS2的电子式为: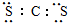 | B. | Ca2+的离子结构示意图为: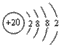 | ||
| C. | HClO的结构式为:H-O-Cl | D. | 氯化铵的电子式为: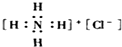 |
①乙烯的结构简式:CH2CH2
②明矾的化学式:KAlSO4•12H2O
③CSO的电子式:

④铬原于价电子层排布图

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+
⑧淀粉的分子式:(C6H10O5)n
⑨对硝基苯酚的结构简式:

⑩Cl-的结构示意图

| A. | ③④⑤⑧ | B. | ③⑤⑧ | C. | ③⑤⑧⑨ | D. | ①③⑤⑥⑦⑧⑩ |
| A. | 两者都含s-s σ 键 | B. | 两者都含p-p σ 键 | ||
| C. | 前者含p-p σ 键,后者含s-p σ 键 | D. | 两者都含p-p π 键 |
| A. | 铍是一种轻金属,它的氧化物对应水化物可能是两性 | |
| B. | 砹是一种有色固体,其气态氢化物很不稳定,砹化银是有色不溶于稀HNO3的沉淀 | |
| C. | 硫酸锶难溶于水和稀HNO3,其氢氧化物为强酸 | |
| D. | 硒化氢是无色气体,没有H2S稳定 |
| A. | 乙烯的结构简式:CH2 CH2 | |
| B. | 硫离子结构示意图: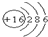 | |
| C. | CaF2的电子式: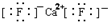 | |
| D. | 硫酸铁的电离方程式:Fe2(SO4)3=Fe23++3SO42- |
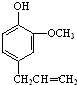 ,F是丁子香酚的一种同分异构体,常用于合成药物的中间体,可以通过以下方案合成.A是一种气态烃.密度是同温同压时氢气的14倍.
,F是丁子香酚的一种同分异构体,常用于合成药物的中间体,可以通过以下方案合成.A是一种气态烃.密度是同温同压时氢气的14倍.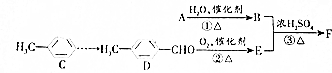
 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$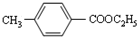 +H2O;
+H2O;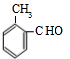 、
、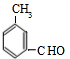 、
、