题目内容
6.高铁酸盐在环保、能源等方面有着广泛的用途.Ⅰ.高铁酸钾(K2FeO4)具有强氧化性,是一种理想的水处理剂,试解释其原因高铁酸钾具有强氧化性,能起到杀菌、消毒作用,产生Fe3+能水解生成Fe(OH)3胶体,能起到净水作用.
Ⅱ.高铁电池的研制也在进行中.如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3↓+5OH-.
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向右移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向左移动(填“左”或“右”).
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有使用时间长、工作电压稳定.
Ⅲ.工业上湿法制备K2FeO4的工艺流程如图3.

(1)完成“氧化”过程中反应的化学方程式:
2FeC13+3NaC1O+10NaOH=2Na2FeO4+9NaCl+5H2O
(2)加入饱和KOH溶液的目的是减小高铁酸钾的溶解,促进高铁酸钾晶体析出.
(3)己知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L 100mLFeC13溶液,为使配制过程中不出现浑浊现象,则至少需要加入2.5mL2mol/L的盐酸(忽略加入盐酸体积).
分析 I.K2FeO4的强氧化性,可杀菌消毒,还原产物铁离子水解生成胶体;
Ⅱ.(1)由图可知,Zn为负极,C为正极,正极上发生还原反应;
(2)原电池中阴离子向负极移动,阳离子向正极移动;
(3)由图可知,高铁电池放电时间长,寿命长;
Ⅲ.由湿法制备的工艺流程可知,氯化铁溶液中加入次氯酸钠和氢氧化钠,发生2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;将Na2FeO4粗产品在40%KOH溶液中溶解,过滤除去杂质NaCl,加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾.
(1)反应中Fe元素化合价升高,Cl元素的化合价降低,结合电子、原子守恒配平方程式;
(2)加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动;
(3)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],代入有关数据后可求出c(OH-),进而计算c(H+),结合溶液稀释前后溶质的物质的量不变计算该题.
解答 解:I.高铁酸钾(K2FeO4)具有强氧化性,是一种理想的水处理剂,其原因为高铁酸钾具有强氧化性,能起到杀菌、消毒作用,产生Fe3+能水解生成Fe(OH)3胶体,能起到净水作用,
故答案为:高铁酸钾具有强氧化性,能起到杀菌、消毒作用,产生Fe3+能水解生成Fe(OH)3胶体,能起到净水作用;
Ⅱ.(1)由图可知,Zn为负极,C为正极,该电池放电时正极的电极反应式为FeO42-+4H2O+3e-=Fe(OH)3↓+5OH-,
故答案为:FeO42-+4H2O+3e-=Fe(OH)3↓+5OH-;
(2)原电池中阴离子向负极移动,阳离子向正极移动,则盐桥中盛有饱和KCl溶液,此盐桥中氯离子向右移动,若用阳离子交换膜代替盐桥,则钾离子向左移动,
故答案为:右;左;
(3)由图2这高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有使用时间长、工作电压稳定,
故答案为:使用时间长、工作电压稳定;
Ⅲ.(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+3NaClO+10NaOH=2Na2FeO4+9NaCl+5H2O,
故答案为:2;3;10;2;9;5;
(2)Na2FeO4+2KOH?K2FeO4+2NaOH,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,则加入饱和KOH溶液的目的是减小高铁酸钾的溶解,促进高铁酸钾晶体析出,
故答案为:减小高铁酸钾的溶解,促进高铁酸钾晶体析出;(1)2FeC13+3NaC1O+10NaOH=2NaFeO4+9NaCl+5H2O(2分)
(3)若不出现浑浊现象,则c(Fe3+)×C3(OH-)≤Ksp[Fe(OH)3],则c(OH-)≤$\root{3}{\frac{4.0×1{0}^{-38}}{5}}$=2×10-13mol/L,c(H+)≥0.05mol/L,则加入盐酸的体积至少为$\frac{0.1L×0.05mol/L}{2mol/L}$=0.0025L=2.5mL,
故答案为:2.5.
点评 本题考查物质的制备实验,为高频考点,把握制备流程中的反应、混合物分离提纯、原电池及氧化还原反应、Ksp计算等为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度中等.

| A. | Cu | B. | CaCO3 | C. | Zn | D. | AgNO3 |
| A. | 该反应的正反应的活化能大于100kJ•mol-1 | |
| B. | 加入适当催化剂,可以改变该反应历程 | |
| C. | 一定条件下,v正(M)=2v逆(N)时,该反应达到平衡状态 | |
| D. | 断裂2分子M中的化学键吸收的能量比断裂1分子N中的化学键吸收的能量多100kJ |
| A. | 物质均由原子或分子构成 | |
| B. | 已知的大部分物质属于有机物 | |
| C. | 食品加工中应严禁使用人工合成的物质 | |
| D. | 干冰、可燃冰属于同种物质 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向淀粉水解后的溶液中加入碘水 | 溶液变蓝色 | 淀粉没有水解 |
| B | 用黄铜片在铜片上刻画 | 铜片上有划痕 | 铜的硬度比黄铜小 |
| C | 用洁净的铁丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 溶液中一定含有Na+,可能含有K+ |
| D | 向硅酸钠溶液中滴加乙酸溶液 | 溶液变浑浊 | 相同条件下,乙酸的酸性一定比硅酸强 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |
| A. | 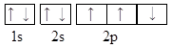 | B. | 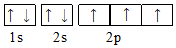 | ||
| C. | 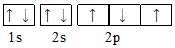 | D. | 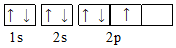 |
| A. | 1L2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| B. | 电解精炼铜时,若阴极得电子数为2NA,则阳极质量减少64g | |
| C. | 1mol聚苯乙烯分子有碳碳双键的数目为NA | |
| D. | 1molMg在空气中燃烧生成MgO(含少量Mg3N2)失去电子数为2NA |
