题目内容
17.已知:2M(g)?N(g),△H=+100kJ•mol-1,下列说法不正确的是( )| A. | 该反应的正反应的活化能大于100kJ•mol-1 | |
| B. | 加入适当催化剂,可以改变该反应历程 | |
| C. | 一定条件下,v正(M)=2v逆(N)时,该反应达到平衡状态 | |
| D. | 断裂2分子M中的化学键吸收的能量比断裂1分子N中的化学键吸收的能量多100kJ |
分析 A.反应热为正逆反应的活化能之差;
B.加入催化剂,降低反应的活化能;
C.达到平衡时,正逆反应速率相等;
D.应为2molM与1molN的键能之差.
解答 解:A.反应热为正逆反应的活化能之差,则该反应的正反应的活化能大于100kJ•mol-1,故A正确;
B.加入催化剂,降低反应的活化能,改变反应的历程,故B正确;
C.如v正(M)=2v逆(N),说明正逆反应速率相等,则达到平衡状态,故C正确;
D.应为2molM与1molN的键能之差,可根据反应热的单位判断,故D错误.
故选D.
点评 本题考查反应热与焓变,为高频考点,题目难度不大,明确热化学方程式中系数的含义为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
7.下列物质的水溶液能导电,但其本身属于非电解质的是( )
| A. | 液氯 | B. | 干冰 | C. | 酒精 | D. | 金属钠 |
8.下列说法中,正确的是( )
| A. | SiO2和CO2常温都是气体分子 | |
| B. | CO2、SiO2均能和氢氟酸反应 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | CO2、SiO2分别是H2CO3、H2SiO3的酸酐,因而均可由CO2、SiO2与水反应制得相应酸 |
5.某工业生产经过以下转化步骤:
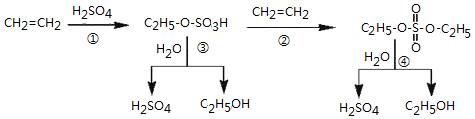
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 该过程可以制取乙醇 | |
| B. | 已知C2H5-O-SO3H属于酯,所以该过程中①和②都是酯化反应 | |
| C. | 该过程中③和④是取代反应 | |
| D. | C2H5-O-SO3H具有酸性 |
12.设NA为阿伏伽德罗常数值,下列叙述不正确的是( )
| A. | 淀粉可用于酿酒 | |
| B. | 13g苯中含C-H键的数目是NA | |
| C. | 1mol的金刚石中含4NA根C-C键 | |
| D. | 标准状况下,11.2L甲烷和乙烯的混合物含氢原子数是2NA |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 46gNO2和N2O4的混合气体中含有的原子个数为3NA | |
| B. | 标准状况下,22.4L乙醇完全燃烧后生成的CO2分子数为2NA | |
| C. | 1mol苯中所含的碳碳双键数为3NA | |
| D. | 1mol Cl2与过量Fe反应,转移的电子数为3NA |
9.已知某烃A相对氢气的密度为35,且该烃不能使溴的四氯化碳溶液褪色,则A的可能结构共有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
8.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |

