题目内容
12.下列反应过程中的能量变化情况符合图的是( )
| A. | 酸与碱的中和反应 | B. | 石灰石高温分解反应 | ||
| C. | 镁和盐酸的反应 | D. | 氧化钙和水的反应 |
分析 根据图示可以得到产物的能量高于反应物,所以该反应是吸热反应,根据常见的吸热反应知识来回答.
解答 解:根据图示内容:生成物的能量高于反应物的能量,反应是吸热反应.
A、酸与碱的中和反应是放热反应,故A错误;
B、石灰石高温分解反应属于吸热反应,故B正确;
C、镁和盐酸的反应是放热反应,故C错误;
D、生石灰与水反应是放热反应,故D错误;
故选B.
点评 本题考查学生生常见的吸热反应和放热反应以及吸热反应和放热反应的判断,可以根据所学知识进行回答,较简单.

练习册系列答案
相关题目
2.已知R2+离子核外有a个电子,b个中子.表示R原子组成正确的是( )
| A. | ${\;}_{a}^{b}$ R | B. | ${\;}_{a-2}^{a+b-2}$ R | C. | ${\;}_{a+2}^{a+b+2}$ R | D. | ${\;}_{a-2}^{a+b}$ R |
20.为测定某血液样品中钙离子的含量,可取该样品2.00mL用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀.将沉淀用稀硫酸处理得H2C2O4后,再用1.000×10-4mol•L-1酸性KMnO4标准溶液滴定,到达终点时用去20.00mL标准液.则下列说法中错误的是( )
| A. | 用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液应用式碱滴定管盛装 | |
| C. | 滴定终点时的现象为:最后1滴标准KMnO4(aq)使锥形瓶中溶液由无色变为浅紫色,且约半分钟内不褪色 | |
| D. | 经计算该样品中钙离子浓度为1.000×10-4g•mL-1 |
7.pmolC2H4在密闭容器中加强热分解,达到平衡时生成mmolC2H2和nmolH2,将平衡混合气体完全燃烧生成水和二氧化碳,要消耗氧气( )
| A. | ($\frac{3m}{2}$+$\frac{n}{2}$+2p)mol | B. | (3p-$\frac{3m}{2}$-$\frac{n}{2}$)mol | C. | 3pmol | D. | ($\frac{3m}{2}$+$\frac{n}{2}$)mol |
17.在1.01×105Pa、150℃条件下,某烃完全燃烧反应前后压强不发生变化,该有机物可能是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
4.实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量).请回答下列问题:
(1)试分析CO2和SO2 是怎么样产生的?乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2(用一句话说明).
(2)试用如图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:④②①③.
(3)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则C瓶的作用是检验SO2是否除尽.
(4)装置②中所加的试剂名称是无水硫酸铜,简述确定装置②在整套装置中的位置的理由是①③导出的气体带有水蒸气,影响水蒸气的确定.
(1)试分析CO2和SO2 是怎么样产生的?乙醇或乙烯与浓硫酸发生氧化还原反应生成CO2和SO2(用一句话说明).
(2)试用如图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:④②①③.
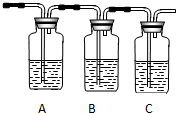 品红溶液 KMnO4 溶液品红溶液 品红溶液 KMnO4 溶液品红溶液 ① |  ② ② | 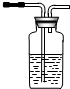 ③ |  ④ |
(4)装置②中所加的试剂名称是无水硫酸铜,简述确定装置②在整套装置中的位置的理由是①③导出的气体带有水蒸气,影响水蒸气的确定.
1.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数c>d,离子的还原性Y2->Z- | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>X |
2.下列装置能达到实验目的是( )
| A. |  检验产物中含有乙烯 | B. |  除去CO中混有少量的CO2 | ||
| C. |  验证减压蒸馏原理 | D. |  收集NH3 |