题目内容
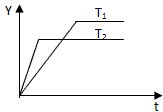 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )| A、N2的转化率 |
| B、混合气体的平均摩尔质量 |
| C、容器的体积 |
| D、混合气体的密度 |
考点:化学反应速率的概念,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:由图可知,温度T2到达平衡所用时间短,反应速率较快,故温度T2>T1,温度升高,Y表示的物理量降低,该反应正反应为放热反应,升高温度平衡向逆反应移动,据此结合选项进行判断.
解答:
解:由图可知,温度T2到达平衡所用时间短,反应速率较快,故温度T2>T1,温度升高,Y表示的物理量降低,该反应正反应为放热反应,升高温度平衡向逆反应移动,
A、该反应正反应为放热反应,升高温度平衡向逆反应移动,N2的转化率降低,图象与实际符合,故A正确;
B、升高温度平衡向逆反应移动,混合气体的总的物质的量增大,混合气体的总质量不变,则混合气体的平均摩尔质量减小,与Y表示的变化相符,故B正确;
C、升高温度平衡向逆反应移动,容器的体积增大,与Y表示的物理量变化不符,故C错误;
D、该反应正反应为放热反应,升高温度平衡向逆反应移动,但混合气体的总质量不变,压强恒定,容器的体积减小,混合气体的密度增大,与Y表示的物理量变化不符,故D错误;
故选AB.
A、该反应正反应为放热反应,升高温度平衡向逆反应移动,N2的转化率降低,图象与实际符合,故A正确;
B、升高温度平衡向逆反应移动,混合气体的总的物质的量增大,混合气体的总质量不变,则混合气体的平均摩尔质量减小,与Y表示的变化相符,故B正确;
C、升高温度平衡向逆反应移动,容器的体积增大,与Y表示的物理量变化不符,故C错误;
D、该反应正反应为放热反应,升高温度平衡向逆反应移动,但混合气体的总质量不变,压强恒定,容器的体积减小,混合气体的密度增大,与Y表示的物理量变化不符,故D错误;
故选AB.
点评:本题考查化学平衡图象,难度中等,根据图象曲线变化判断温度高低是关键,结合平衡移动进行解答.

练习册系列答案
相关题目
在容积为2L的容器内发生反应:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0,起始时充入1mol CO和0.8mol H2O,经过2min后,反应达到平衡状态,此时CO2的浓度为0.2mol?L-1,下列说法正确的是( )
| 催化剂 |
| 加热 |
A、该反应的平衡常数为:K=
| ||
| B、CO和H2O的转化率相同 | ||
| C、2min内,用H2表示的反应速率为:v(H2)=0.lmol/(L?min) | ||
| D、升高温度时,V正减小,v逆增大 |
对于可逆反应:mA(g)+nB(g)?xC(g)△H=?,在不同温度及压强(P1,P2)条件下,反应物A的转化率如下图所示,下列判断正确的是( )


| A、△H>0,m+n>x |
| B、△H<0,m+n>x |
| C、△H>0,m+n<x |
| D、△H<0,m+n<x |
已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合后pH=2,则a:b为( )
| A、9:2 | B、7:1 |
| C、5 | D、8:3 |

 A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
 原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时s能级上的电子总数是p能级上电子总数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子,W的外围电子构型是3d104s1.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时s能级上的电子总数是p能级上电子总数的2倍.Z原子基态时2p原子轨道上有3个未成对的电子,W的外围电子构型是3d104s1.回答下列问题: