题目内容
A、B、C、D均为中学常见的纯净物,B为地壳中含量最多的元素所形成的单质.它们之间有如图转化关系(副产物已略去):

(1)若D的焰色反应为黄色的固体单质.C与CO2反应的化学方程式 ,盛放A的水溶液的试剂瓶不能用玻璃塞的原因 .(用离子方程式表示)
(2)若D遇蘸有浓HCl的玻璃棒立即产生白烟的气体.D的电子式 ,D催化氧化生成A的化学方程式 ,C与水反应化学方程式 ,由D、B和NaOH溶液构成的燃料电池且产物无污染,写出负极的电极反应式 .(用离子方程式表示)
(3)若D为淡黄色固体单质.则C属于 (填“极性”或“非极性”)分子,A生成C的化学方程式 .将A通入FeCl3溶液反应的离子方程式 ,A的水溶液放置在空气中,溶液的PH值逐渐减少的原因 .(用离子方程式表示)
(4)若D是硬度最大的非金属固体单质.C中D元素的杂化方式 ,若C中含有A的杂质,除去杂质的试剂为灼热 ,若A中含有C的杂质,除去杂质的化学方程式 ,Mg在C中燃烧的化学方程式 .

(1)若D的焰色反应为黄色的固体单质.C与CO2反应的化学方程式
(2)若D遇蘸有浓HCl的玻璃棒立即产生白烟的气体.D的电子式
(3)若D为淡黄色固体单质.则C属于
(4)若D是硬度最大的非金属固体单质.C中D元素的杂化方式
考点:无机物的推断
专题:推断题
分析:B为地壳中含量最多的元素所形成的单质,则B为O2.
(1)若D的焰色反应为黄色的固体单质,能与氧气连续反应,则D为Na,A为氧化钠,C为过氧化钠;
(2)若D遇蘸有浓HCl的玻璃棒立即产生白烟的气体,则D为氨气,A为NO,C为二氧化氮;
(3)若D为淡黄色固体单质,则D为硫,A为二氧化硫,C为三氧化硫;
(4)若D是硬度最大的非金属固体单质,则D为碳,A为CO,C为二氧化碳.
(1)若D的焰色反应为黄色的固体单质,能与氧气连续反应,则D为Na,A为氧化钠,C为过氧化钠;
(2)若D遇蘸有浓HCl的玻璃棒立即产生白烟的气体,则D为氨气,A为NO,C为二氧化氮;
(3)若D为淡黄色固体单质,则D为硫,A为二氧化硫,C为三氧化硫;
(4)若D是硬度最大的非金属固体单质,则D为碳,A为CO,C为二氧化碳.
解答:
解:B为地壳中含量最多的元素所形成的单质,则B为O2.
(1)若D的焰色反应为黄色的固体单质,能与氧气连续反应,则D为Na,A为氧化钠,C为过氧化钠,C与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,A的水溶液为NaOH,试剂瓶不能用玻璃塞的原因:SiO2+2OH-=SiO32-+H2O,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O;
(2)若D遇蘸有浓HCl的玻璃棒立即产生白烟的气体,则D为氨气,A为NO,C为二氧化氮,氨气的电子式为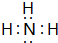 ,氨气催化氧化生成NO的化学方程式为:4NH3+5O2
,氨气催化氧化生成NO的化学方程式为:4NH3+5O2
4NO+6H2O,二氧化氮与水反应化学方程式为:3NO2+H2O=2HNO3+NO,由氨气、氧气和NaOH溶液构成的燃料电池且产物无污染,反应生成氮气与水,负极发生氧化反应,氨气在负极放电,生成氮气与水,2NH3+6OH--6e-=N2+6H2O,
故答案为: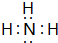 ;4NH3+5O2
;4NH3+5O2
4NO+6H2O;3NO2+H2O=2HNO3+NO;2NH3+6OH--6e-=N2+6H2O;
(3)若D为淡黄色固体单质,则D为硫,A为二氧化硫,C为三氧化硫,三氧化硫为平面正三角形,分子中正负电荷重心重合,属于非极性分子,A生成C的化学方程式为:2SO2+O2
2SO3.将SO2通入FeCl3溶液反应的离子方程式为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+,A的水溶液放置在空气中,溶液的PH值逐渐减少的原因:2SO2+O2+2H2O=SO42-+4H+,
故答案为:非极性;2SO2+O2
2SO3;SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;2SO2+O2+2H2O=SO42-+4H+;
(4)若D是硬度最大的非金属固体单质,则D为碳,A为CO,C为二氧化碳,则:
二氧化碳中碳原子价层电子对数为2+
=2,碳原子采取sp杂化,若二氧化碳中含有CO的杂质,除去杂质的试剂为灼热CuO等,若CO中含有二氧化碳的杂质,可以用NaOH溶液吸收除去,除去杂质的化学方程式:CO2+2NaOH=Na2CO3+H2O,Mg在二氧化碳中燃烧的化学方程式为:2Mg+CO2
2MgO+C,
故答案为:sp;CuO;CO2+2NaOH=Na2CO3+H2O;2Mg+CO2
2MgO+C.
(1)若D的焰色反应为黄色的固体单质,能与氧气连续反应,则D为Na,A为氧化钠,C为过氧化钠,C与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,A的水溶液为NaOH,试剂瓶不能用玻璃塞的原因:SiO2+2OH-=SiO32-+H2O,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;SiO2+2OH-=SiO32-+H2O;
(2)若D遇蘸有浓HCl的玻璃棒立即产生白烟的气体,则D为氨气,A为NO,C为二氧化氮,氨气的电子式为
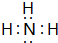 ,氨气催化氧化生成NO的化学方程式为:4NH3+5O2
,氨气催化氧化生成NO的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:
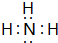 ;4NH3+5O2
;4NH3+5O2
| ||
| △ |
(3)若D为淡黄色固体单质,则D为硫,A为二氧化硫,C为三氧化硫,三氧化硫为平面正三角形,分子中正负电荷重心重合,属于非极性分子,A生成C的化学方程式为:2SO2+O2
| 催化剂 |
| △ |
故答案为:非极性;2SO2+O2
| 催化剂 |
| △ |
(4)若D是硬度最大的非金属固体单质,则D为碳,A为CO,C为二氧化碳,则:
二氧化碳中碳原子价层电子对数为2+
| 4-2×2 |
| 2 |
| ||
故答案为:sp;CuO;CO2+2NaOH=Na2CO3+H2O;2Mg+CO2
| ||
点评:本题考查无机物推断,属于开放性题目,题目综合较大,需要学生熟练掌握元素化合物中学,具备扎实的基础,难度中等.

练习册系列答案
相关题目
在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g)?2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
| A、40% | B、50% |
| C、60% | D、70% |
下列关于糖类、脂肪和蛋白质的叙述正确的是( )
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、葡萄糖能发生氧化反应和水解反应 |
| D、蛋白质溶液遇CuSO4后产生的沉淀能重新溶解 |
下列各组中的离子,能在溶液中大量共存的是( )
| A、I- NO3- SiO32- H+ |
| B、K+ Fe3+ Cl- SO42- SCN- |
| C、K+ AlO2- SO42- NO3- |
| D、NH4+ OH- Cl- HCO3- |
如图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )
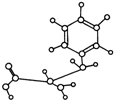

| A、能与NaOH发生反应,但不能与盐酸反应 |
| B、能合成高分子化合物 |
| C、能发生加成反应 |
| D、能发生水解反应 |
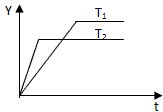 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )| A、N2的转化率 |
| B、混合气体的平均摩尔质量 |
| C、容器的体积 |
| D、混合气体的密度 |
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表: 钙是人体神经、骨骼系统等功能功能正常动作所必需的常量元素.某药业公司的钙片包装上有如下说明:
钙是人体神经、骨骼系统等功能功能正常动作所必需的常量元素.某药业公司的钙片包装上有如下说明: