题目内容
已知t℃,KW=1×10-13,在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合后pH=2,则a:b为( )
| A、9:2 | B、7:1 |
| C、5 | D、8:3 |
考点:pH的简单计算
专题:
分析:t℃,KW=1×10-13>1×10-14,pH=11的NaOH溶液中氢氧根离子浓度为:
=0.01mol/L,pH=1的硫酸溶液中氢离子浓度为0.1mol/L
;将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合,若所得混合溶液的pH=2,则硫酸过量,利用剩余氢离子的浓度计算a:b.
| 1×10-13 |
| 1×10-11 |
;将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合,若所得混合溶液的pH=2,则硫酸过量,利用剩余氢离子的浓度计算a:b.
解答:
t℃,KW=1×10-13>1×10-14,pH=11的NaOH溶液中氢氧根离子浓度为:
=0.01mol/L,pH=1的硫酸溶液中氢离子浓度为0.1mol/L,
a L该氢氧化钠溶液与pH=1的H2SO4的溶液b L混合,若所得混合溶液的pH=2,
则:
=0.01mol/L,
解得:a:b=9:2,
故选A.
| 1×10-13 |
| 1×10-11 |
a L该氢氧化钠溶液与pH=1的H2SO4的溶液b L混合,若所得混合溶液的pH=2,
则:
| bL×0.1mol/L-aL×0.01mol/L |
| aL+bL |
解得:a:b=9:2,
故选A.
点评:本题考查pH的有关计算,题目难度中等,熟悉Kw及氢离子的浓度的换算是解答的关键,注意掌握溶液pH的概念及计算方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
向a mL 0.25mol/L的AlCl3溶液中加入金属钠,反应完全后恰好形成NaCl和NaAlO2的混合溶液,则加入金属钠的物质的量为( )
| A、2.5a×10-4mol |
| B、5a×10-4mol |
| C、7.5a×10-4mol |
| D、a×10-3mol |
下列气体通入水中,所得溶液呈碱性的是( )
| A、Cl2 |
| B、NO2 |
| C、CO2 |
| D、NH3 |
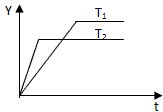 已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )
已知反应N2(g)+3H2(g)?2NH3(g);△H<0,向某压强恒定、体积可变的容器中按体积比1:3充入N2和H2,在一定条件下发生反应.如图是某物理量Y随时间(t)变化的示意图,Y可能是( )| A、N2的转化率 |
| B、混合气体的平均摩尔质量 |
| C、容器的体积 |
| D、混合气体的密度 |
下列各组离子中,能在溶液中大量共存的是( )
| A、Ca2+、NO3-、K+、CO32- |
| B、NH4+、Cl-、OH-、Na+ |
| C、CO32-、Na+、K+、OH- |
| D、Na+、Ag+、H+、I- |
日本福岛核电站泄漏物中含有放射性的
I.有关
I的说法正确是( )
131 53 |
131 53 |
| A、核外电子数为78 | ||
B、与
| ||
| C、中子数为131 | ||
D、与
|
在下列各组物质中,只有还原性的是( )
| A、Cl- CO Na+、 |
| B、Na Cl- S2- |
| C、Fe3+ SO42- NO3- |
| D、Fe2+ O2 H2S |