题目内容
11.25℃时0.1mol•L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液.当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为NaHR(填化学式).分析 氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,据此分析.
解答 解:25℃时0.1mol•L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液,溶液中存在c(Na+)=c(R2-)+c(HR-)+c(H2R),说明钠原子和R原子以1:1存在于盐溶液中,R形成的酸为二元酸,所以该溶质为二元酸的酸式盐,即NaHR;
故答案为:NaHR.
点评 本题考查了弱电解质在溶液中的电离平衡,侧重于学生的分析能力和计算能力的考查,注意把握溶液中的电荷守恒以及物料守恒,题目难度不大.

练习册系列答案
相关题目
2.下列叙述中正确的是( )
| A. | 体积相同、浓度均为0.1 mol•L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n | |
| B. | 有甲、乙两氨水溶液,测得甲的pH=a,乙的pH=a+1,则甲乙两溶液c(H+)之比为10:1 | |
| C. | 相同温度下,0.2 mol•L-1乙酸溶液与0.1 mol•L-1乙酸溶液中c(H+)之比为2:1 | |
| D. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,K=$\frac{c{α}^{2}}{c(1-α)}$.若加入少量醋酸钠固体,则CH3COOH?CH3COO-+H+向左移动,α减小,K变小 |
6.如表是不同温度下水的离子积常数:
试回答以下问题:
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
(1)90℃时,将pH=3的硫酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L(保留三位有效数字).
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,则Na2SO4溶液呈碱性(填“酸”、“碱”或“中”),0.1mol•L-1的NaHSO4溶液的c(H+)>0.01mol•L-1(填“>”、“<”或“=”) H2SO4溶液与Na2SO4溶液反应的离子方程式为H++SO42-=HSO4-.
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值为1:2;再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值为1:20.
13.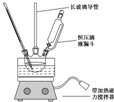 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和100ml 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1) +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+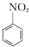 +H2O
+H2O
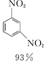
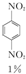
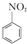 +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$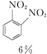 +
+ +
+
(2)可能用到的有关数据如表
请回答下列问题:
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应温度控制在50~60℃的原因是防止副反应发生.
(5)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(6)实验前要配制100ml 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器有玻璃棒、100ml容量瓶、胶头滴管、烧杯 用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(7)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,加入漏斗中,把18mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50~60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和100ml 0.1mol/L的Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 +HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+
+HNO3(浓)$\frac{50~60℃}{98%浓{H}_{2}S{O}_{4}}$+ +H2O
+H2O +HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$
+HNO3(浓)$\frac{95%}{98%浓{H}_{2}S{O}_{4}}$ +
+ +
+
(2)可能用到的有关数据如表
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
(1)配制混酸应在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应温度控制在50~60℃的原因是防止副反应发生.
(5)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(6)实验前要配制100ml 0.1mol/L的Na2CO3溶液,需要用到的玻璃仪器有玻璃棒、100ml容量瓶、胶头滴管、烧杯 用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(7)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏.
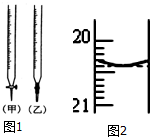 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题: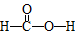 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: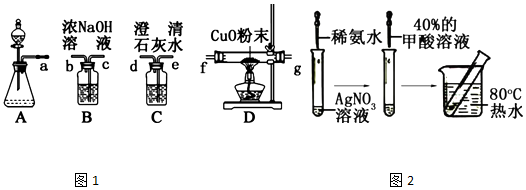
 根据要求回答下列问题:
根据要求回答下列问题: