��Ŀ����
��ij�¶��£�����㶨���ܱ������м���2molN2��4molH2���������·�Ӧ��
N2��g��+3H2��g��?2NH3��g������H=-92.4kJ/mol���ﵽƽ��ʱ���ų�����46.2kJ����
��1���ﵽƽ��ʱ��N2��ת����Ϊ ��NH3���������Ϊ ��
��2������������м���a mol N2��b mol H2��c mol NH3����a��b��c��Ϊ����������ͬ�����´ﵽƽ��ʱ��������и���ֵ����ʵ���������ƽ����ͬ��a��b��cȡֵ���������һ�������� �� ��
��3����ѧ�ҷ�����ʹNH3ֱ������ȼ�ϵ�صķ�������װ���ò������缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ��NH3�������ܷ�ӦʽΪ��4NH3+3O2=2N2+6H2O���������ҺӦ�� ������ԡ��������ԡ����ԡ�����д�������ĵ缫��Ӧ����ʽ ��
N2��g��+3H2��g��?2NH3��g������H=-92.4kJ/mol���ﵽƽ��ʱ���ų�����46.2kJ����
��1���ﵽƽ��ʱ��N2��ת����Ϊ
��2������������м���a mol N2��b mol H2��c mol NH3����a��b��c��Ϊ����������ͬ�����´ﵽƽ��ʱ��������и���ֵ����ʵ���������ƽ����ͬ��a��b��cȡֵ���������һ��������
��3����ѧ�ҷ�����ʹNH3ֱ������ȼ�ϵ�صķ�������װ���ò������缫������������Һ�У�һ���缫ͨ���������һ�缫ͨ��NH3�������ܷ�ӦʽΪ��4NH3+3O2=2N2+6H2O���������ҺӦ��
���㣺��ѧƽ��ļ���,��ѧ��Դ���͵��,��Чƽ��
ר�⣺��ѧƽ��ר��,�绯ѧר��
��������1�����ݷų��������������Ȼ�ѧ����ʽ����μӷ�Ӧ�ĵ��������ʵ������ٸ���ת���ʶ�����㵪����ת���ʣ�
��2���¶Ⱥ㶨����㶨���÷�Ӧǰ����������ʵ��������仯���ʰ���ѧ������ת�����������n��N2��=2mol��n��H2��=4mol���ɣ�
��3������Ϊ�������壬�����ᷴӦ��Ӧ�ü��Ե���ʣ���������������Ӧ��
��2���¶Ⱥ㶨����㶨���÷�Ӧǰ����������ʵ��������仯���ʰ���ѧ������ת�����������n��N2��=2mol��n��H2��=4mol���ɣ�
��3������Ϊ�������壬�����ᷴӦ��Ӧ�ü��Ե���ʣ���������������Ӧ��
���
�⣺��1���ﵽƽ��ʱ���ų�����46.2kJ�����Բμӷ�Ӧ�ĵ��������ʵ���Ϊ
=0.5mol�����ɰ������ʵ���Ϊ1mol�����ݻ�ѧ����ʽǰ���������ʵ����仯�������ɵİ������ʵ����Ƿ�Ӧǰ�������С�����ʵ��������Ե�����ת����Ϊ
��100%=25%���������������=
��100%=20%��
�ʴ�Ϊ��25%��20%��
��2���¶Ⱥ㶨����㶨���÷�Ӧǰ����������ʵ��������仯���ʰ���ѧ������ת�����������n��N2��=2mol��n��H2��=4mol���ɣ���a+
c=2��b+
c=4��
�ʴ�Ϊ��a+
c=2��b+
c=4��
��3������Ϊ�������壬�����ᷴӦ�����Ե������ҺӦ�ʼ��ԣ���������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ�����ԣ�2NH3-6e-+6OH-=N2+6H2O��
| 46.2KJ/ |
| 92.4KJ/mol |
| 0.5mol |
| 2mol |
| 1mol |
| 2mol+4mol-1mol |
�ʴ�Ϊ��25%��20%��
��2���¶Ⱥ㶨����㶨���÷�Ӧǰ����������ʵ��������仯���ʰ���ѧ������ת�����������n��N2��=2mol��n��H2��=4mol���ɣ���a+
| 1 |
| 2 |
| 3 |
| 2 |
�ʴ�Ϊ��a+
| 1 |
| 2 |
| 3 |
| 2 |
��3������Ϊ�������壬�����ᷴӦ�����Ե������ҺӦ�ʼ��ԣ���������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ�����ԣ�2NH3-6e-+6OH-=N2+6H2O��
���������鷴Ӧ�ȵ��йؼ��㡢��ѧƽ����㡢��Чƽ��ȣ����յ缫��Ӧʽ����д���Ѷ��еȣ�ע���Чƽ����ɵ��������գ�

��ϰ��ϵ�д�
 ���Ŀ����ϵ�д�
���Ŀ����ϵ�д� ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д�
�����Ŀ
����˵������ȷ���ǣ�������
| A�������ԭˮ����ȵ��ˮ��������ܻ����������� |
| B��������ˮ����NH4+��NH3�����û�ѧ��������绯ѧ���������� |
| C��ij�ֹ�ѧ��⼼�����м��ߵ������ȣ��ɼ�����ϸ����V��10-12L���ڵ�����Ŀ����ӣ��ݴ˿�����ü�⼼���ܼ��ϸ����Ũ��ԼΪ10-12-10-11mol?L-1��Ŀ����� |
| D�������������Ӽ״��û��ȼ�ϵ���ֵ���� |
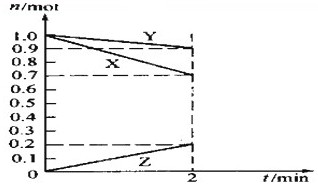
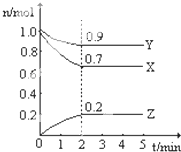 I��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
I��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�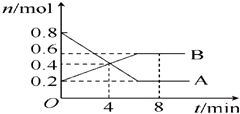
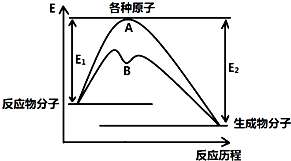 ��֪ij��Ӧ�ڲ�ͬ�����µķ�Ӧ���̿��Ա�ʾ����ͼ��ʾ��E1��ʾ��Ӧ����ӱ��ԭ�������յ�������E2��ʾ��Щԭ�����³ɼ��γ�������ų�����������ش��������⣺
��֪ij��Ӧ�ڲ�ͬ�����µķ�Ӧ���̿��Ա�ʾ����ͼ��ʾ��E1��ʾ��Ӧ����ӱ��ԭ�������յ�������E2��ʾ��Щԭ�����³ɼ��γ�������ų�����������ش��������⣺
 ��1����ӦA+3B=2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ
��1����ӦA+3B=2C+2D�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ