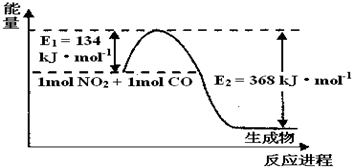
题目内容
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性氰化物的千分之一),氰酸盐进一步被氧化成无毒物质.
(1)某厂废水中含有KCN,其浓度为650mg/L.现用氯氧法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是 .
(2)加入过量液氯,可将氰酸盐进一步氧化成氮气.化学方程式:2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O.若处理上述废水20L,使KCN完全转化为无毒物质,至少需要液氯 g.
(1)某厂废水中含有KCN,其浓度为650mg/L.现用氯氧法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,被氧化的元素是
(2)加入过量液氯,可将氰酸盐进一步氧化成氮气.化学方程式:2KOCN+4KOH+3Cl2=2CO2+N2↑+6KCl+2H2O.若处理上述废水20L,使KCN完全转化为无毒物质,至少需要液氯
考点:氧化还原反应,化学方程式的有关计算
专题:计算题,氧化还原反应专题
分析:(1)该反应中,Cl元素化合价由0价变为-1价,C元素化合价由+2价变为+4价,据此判断被氧化的元素;
(2)计算废水中KCN的质量,再根据n=
计算KCN的物质的量,使KCN完全转化为无毒物质,生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,根据电子转移守恒计算n(Cl2),再根据m=nM计算需要氯气的质量.
(2)计算废水中KCN的质量,再根据n=
| m |
| M |
解答:
解:(1)该反应中,Cl元素化合价由0价变为-1价,C元素化合价由+2价变为+4价,所以被氧化的元素是C元素,故答案为:C;
(2)废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为
=0.2mol,使KCN完全转化为无毒物质,应生成CO、N2,整个过程中C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,Cl元素化合价由0价降低为-1价,电子转移守恒可知2×n(Cl2)=0.2mol×(4-2)+0.2mol×[0-(-3)],解得n(Cl2)=0.5mol,故需要氯气的质量为0.5mol×71g/mol=35.5g,
故答案为:35.5.
(2)废水中KCN的质量为650mg/L×20L=13000mg=13g,物质的量为
| 13g |
| 65g/mol |
故答案为:35.5.
点评:本题以氧化还原反应为载体考查了物质的量的计算,明确元素化合价及其变化是解本题关键,根据方程式中各个物理量的关系式解答,题目难度中等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列电池工作时,O2在正极放电的是( )
A、 锌锰电池 |
B、 氢燃料电池 |
C、 铅蓄电池 |
D、 镍镉电池 |
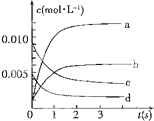 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: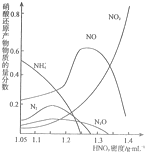 金属(M)的腐蚀是因为发生反应:M-ne-→Mrn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mrn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.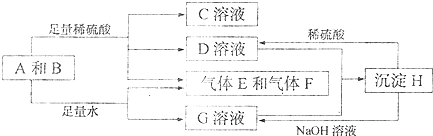
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: