题目内容
6.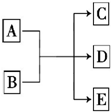 一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图所示,其中A为单质,常温下E为无色液体.(1)若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,则A与B反应的化学方程式是Cl2+2NaOH=NaCl+NaClO+H2O;D溶液可使淀粉KI溶液显蓝色,则D与KI在溶液中反应的离子方程式是2I-+ClO-+H2O=I2+Cl-+2OH-;检验C中所含阴离子的实验方法是取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-.
(2)若A为红色金属,B为某酸的浓溶液,D为可形成酸雨的无色气体.A与B反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.amol A与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是amol≤n(NaOH)≤2amol.
分析 常温下无色液体一般为H2O.
(1)若A、C、D均含氯元素,C为氯碱工业的原料,应为NaCl,D溶液具有漂白性,应为NaClO,则A和B的反应为氯气和NaOH的反应;
(2)若A为红色金属,应为铜,B为某酸的浓溶液,D可形成酸雨的无色气体,应为SO2,则B为浓硫酸.
解答 解:(1)若A、C、D均含氯元素,C为氯碱工业的原料,应为NaCl,D溶液具有漂白性,应为NaClO,则A和B的反应为氯气和NaOH的反应,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,具有强氧化性ClO-,可使KI淀粉溶液显蓝色,说明生成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,检验Cl-可利用AgCl不溶于水和硝酸的性质,方法是取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;2I-+ClO-+H2O=I2+Cl-+2OH-;取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-;
(2)若A为红色金属,应为铜,B为某酸的浓溶液,D可形成酸雨的无色气体,应为SO2,则B为浓硫酸,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
amol Cu完全反应生成amolSO2,与NaOH反应可生成NaHSO3和Na2SO3,则所需NaOH的物质的量的范围是a mol≤n(NaOH)≤2a mol,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;a mol≤n(NaOH)≤2a mol;
点评 本题考查无机物的推断,题目难度中等,本题注意根据常见元素化合物的性质进行推断,解答好本题,具有扎实的基础知识是关键.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案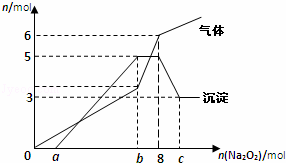 将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+的物质的量分别为( )| A. | 2mol、3mol、6mol | B. | 3mol、2mol、6mol | C. | 2mol、3mol、4mol | D. | 3mol、2mol、2mol |
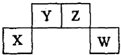 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
| A. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:Cu2++2e-═Cu | |
| B. | 阳极反应:2Cu-2e-+2I-═2CuI 阴极反应:2H++2e-═H2↑ | |
| C. | 阳极反应:2I--2e-═I2 阴极反应:2H++2e-═H2↑ | |
| D. | 阳极反应:Cu-2e-═Cu2+ 阴极反应:2H++2e-═H2↑ |
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、I- | |
| B. | 中性溶液中:K+、SO42-、Fe3+、Na+ | |
| C. | c(H+)/c(OH-)=10-3的溶液中:Na+、K+、CO32-、S2- | |
| D. | 水电离出的H+为10-12溶液:K+、NH4+、Cl-、HCO3- |
| A. | NH4+、Al3+、CO32-、NO3- | B. | K+、Na+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、HCO3-、NO3- |
 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
 +2CH3COOH$\stackrel{浓硫酸}{→}$
+2CH3COOH$\stackrel{浓硫酸}{→}$ +2H2O.
+2H2O.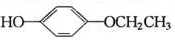 、
、 、
、 、
、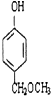 (任写两种)
(任写两种)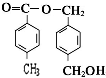 .
.