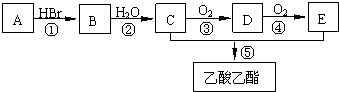
题目内容
3.分析气体体积与物质的量的关系,完成以下练习.(1)标准状况下,2mol CO2的体积为44.8L.
(2)标准状况下,0.15mol NO的体积为3.36L.
(3)标准状况下,0.2mol H2与O2的混合气体体积为4.48L.
分析 在标准状况下Vm=22.4L/mol,根据V=nVm计算.
解答 解:(1)标准状况下,2mol CO2的体积为V=nVm=2mol×22.4L/mol=44.8L;故答案为:44.8L;
(2)标准状况下,0.15mol NO的体积为 V=nVm=0.15mol×22.4L/mol=3.36L;故答案为:3.36L;
(3)标准状况下,0.2mol H2与O2的混合气体体积为V=nVm=0.2mol×22.4L/mol=4.48L;故答案为:4.48L.
点评 本题考查物质量的计算,侧重于学生的计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
13.下列各项中的表述正确的是( )
| A. | 由不同的原子形成的纯净物一定属于化合物 | |
| B. | 一种酸性氧化物只能水化生成一种含氧酸 | |
| C. | 铜、苛性钠都属于金属单质 | |
| D. | NaHCO3、BaSO4都属于强电解质 |
11.从下列事实所得出的解释或结论正确的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| B | 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 | 增大压强,平衡向生成N2O4的方向移动 |
| C | 由水电离出来的c(H+)=1.0×10-13mol/L溶液 | 该溶液为氯化铵水溶液 |
| D | 向含有NH4+、Mg2+、Cu2+、Al3+溶液中加入过量的氢氧化钠溶液微热并搅拌,再加过量的盐酸,其中NH4+大量减少 | NH4+水解 |
| A. | A | B. | B | C. | C | D. | D |
8.根据下表信息,判断0.10mol/L的下列各溶液pH值最大的是( )
| 酸 | 电离常数 |
| CH3COOH | Ki=1.8×10 -5 |
| H2CO3 | Ki1=4.3×10 -7,Ki2=5.6×10 -11 |
| H2S | Ki1=9.1×10 -8,Ki2=1.1×10 -12 |
| H3PO4 | Ki1=7.5×10 -3,Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
| A. | CH3COONa | B. | Na2CO3 | C. | Na2S | D. | Na3PO4 |
9.下列有关实验的说法不正确的是( )
| A. | 用精密pH试纸测得某碱溶液的pH为12.3 | |
| B. | 用25mL酸式滴定管量取13.50mLK2Cr2O7溶液 | |
| C. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| D. | 用带橡皮塞的试剂瓶保存Na2CO3溶液 |
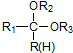 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$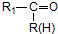
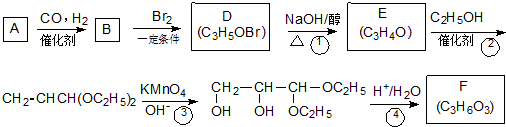
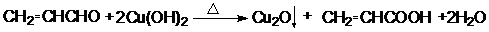 ;
;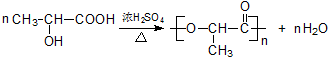 .
.