题目内容
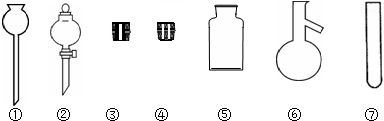
14.海水中有丰富的卤素资源,含量最高的食盐(NaCl)不但是人类生活不可缺少的物质,而且是重要的化工原料.(1)实验室里常用NaCl制取HCl.请在下图中选择合适的仪器用于发生HCl气体:②③⑥(填写仪器编号).
(2)在实验室里使用与制取HCl相同的实验装置和条件,将浓硫酸滴入NaBr(s),可以观察到的现象是先有白雾(或无色气体)产生,很快有红棕色气体生成.
(3)产生上述现象的原因是浓硫酸有强氧化性、-1价的Br元素有还原性,它们发生氧化还原反应生成了Br2;Br2很容易挥发,在加热条件下成为红棕色气体.
(4)收集HCl(g)和HBr(g)的实验时不可缺少的实验操作是:必须用适当的方式吸收尾气.
(5)除水之外,限用 HCl(g)、HBr(g)和HI(g),还需要MnO2或其他合理的氧化剂、CCl4或其他合理的萃取剂(填写试剂的化学式),就能设计实验比较氯、溴、碘的化学活泼性.
(6)工业上可用食盐作为一种主要原料,经不同的方法生产纯碱.联合制碱法(侯氏制碱法)与氨碱法(索氏制碱法)相比,其优点是:提高了食盐的利用率(或充分利用食盐中的钠和氯)、可节省石灰窑和蒸氨塔等设备(或减少CaCO3 制 CO2 这一工序,降低了能耗与污染)和避免产生大量含CaCl2的废液.
分析 (1)实验室用浓硫酸和氯化钠加热反应制取氯化氢,据此选择制取装置;
(2)溴化氢极易溶于水,气态溴单质为红棕色气体;
(3)浓硫酸具有强氧化性,溴化氢具有还原性;
(4)氯化氢和溴化氢有毒需进行尾气处理;
(5)利用氯水与溴化氢反应,再通过萃取检验生成溴,利用溴与HI反应,再通过萃取检验生成碘,需制取氯气;
(6)氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,根据反应原理分析优缺点.
解答 解:(1)浓硫酸具有难挥发性,氯化氢易挥发,所以实验室用浓硫酸和NaCl反应制取HCl,2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl,选择分液漏斗盛放浓硫酸,选择蒸馏烧瓶盛放氯化钠,同时选择单孔活塞,所以需选择的仪器为:②③⑥,
故答案为:②③⑥;
(2)将浓硫酸滴入NaBr(s),2NaBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HBr,生成易溶于水的溴化氢,浓硫酸具有强氧化性,溴化氢被氧化生成溴单质,所以可以观察到的现象是先有白雾(或无色气体)产生,很快有红棕色气体生成,
故答案为:先有白雾(或无色气体)产生,很快有红棕色气体生成;
(3)浓硫酸有强氧化性,溴化氢中-1价的Br元素有还原性,它们发生氧化还原反应生成了Br2,Br2很容易挥发,在加热条件下成为红棕色气体;
故答案为:浓硫酸有强氧化性、-1价的Br元素有还原性,它们发生氧化还原反应生成了Br2;Br2很容易挥发,在加热条件下成为红棕色气体;
(4)氯化氢和溴化氢为有毒气体,不能直接排放到空气中,必须用适当的方式吸收尾气,
故答案为:必须用适当的方式吸收尾气;
(5)利用氯水与溴化钠反应,再通过萃取检验生成溴,利用溴与HI反应,再通过萃取检验生成碘,具体操作与现象为:取少量的溴化氢溶液置于一支洁净的试管中,加入少量四氯化碳溶液,在试管中滴加适量新制氯水,充分振荡,观察到下层油层呈橙(橙红)色,取少量的碘化氢溶液置于一支洁净的试管中,加入少量四氯化碳溶液,在试管中滴加适量制取的溴,充分振荡,观察到下层油层呈紫色,所以还需要MnO2或其他合理的氧化剂、CCl4或其他合理的萃取剂,
故答案为:MnO2或其他合理的氧化剂、CCl4或其他合理的萃取剂;
(6)氨碱法可能的副产物为氯化钙,联合制碱法可能的副产物氯化铵,联合制碱法与氨碱法相比,不产生难以处理的CaCl2,同时可生产出NH4Cl作氮肥,同时提高了食盐的利用率(或充分利用食盐中的钠和氯)、可节省石灰窑和蒸氨塔等设备(或减少CaCO3 制 CO2 这一工序,降低了能耗与污染),
故答案为:提高了食盐的利用率(或充分利用食盐中的钠和氯)、可节省石灰窑和蒸氨塔等设备(或减少CaCO3 制 CO2 这一工序,降低了能耗与污染).
点评 本题考查海水资源的综合利用,是对学生综合能力的考,注意基础知识的理解掌握,注意硫酸、氯及其化合物的性质是解答关键,题目难度中等.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 碘遇淀粉变蓝,故在厨房里可用米汤检验加碘食盐中的碘 | |
| B. | 煤的气化、液化、干馏以及石油的分馏、裂化、裂解均属化学变化 | |
| C. | 明矾和氯气常用作自来水的净化与消毒,其作用原理相同 | |
| D. | 维生素C有还原性,故苹果汁中加入维生素C可防止变黄 |
| A. | 铁原子的质量数均为60 | |
| B. | ${\;}_{26}^{60}$Fe的核内质子数比中子数多8 | |
| C. | 1mol${\;}_{26}^{58}$Fe与足量盐酸反应时均可得到1mol H2 | |
| D. | 等物质的量的${\;}_{26}^{60}$Fe与1mol ${\;}_{26}^{58}$Fe,前者质量比后者多2g |
| A. | 将溶液稀释到原体积的2倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2 mol•L-1盐酸 | D. | 加少量冰醋酸 |
| A. | 会引起化学键的变化 | B. | 必然引起物质状态的变化 | ||
| C. | 必然伴随着能量的变化 | D. | 会产生新的物质 |
| A. | 常温常压下,23gNO2含有NA个氧原子 | |
| B. | 常温常压下,18mLH2O约含有NA个H2O分子 | |
| C. | 含14 NA个电子的N2分子的物质的量是1mol | |
| D. | 0.1mol/L的Ba(OH)2溶液中,OH-的个数为0.2NA个 |