题目内容
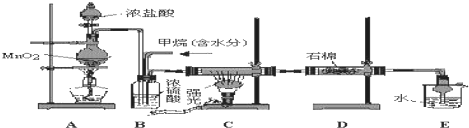
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
(1)B装置有三种功能:①控制气流速度;② ;③
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是
(3)D装置中的石棉上均匀附着KI粉末,其作用是
(4)E装置的作用是 (填编号);
A、收集气体 B、吸收氯气 C、防止倒吸 D、吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出产生黑色小颗粒的化学方程式
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 .该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是 (填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 D.CCl4
(7)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用 溶液吸收多余的氯气.若该溶液配制时不慎浓度过低,发生反应的化学方程式是 .根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是 (填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是 (用字母代号填).
A.O2 B.Cl2 C.CO2 DHClO
(8)据报道,某年某月某日位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故.当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是 .
A.NaOH B.NaCl C.KBr D.Na2CO3
(1)B装置有三种功能:①控制气流速度;②
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是
(3)D装置中的石棉上均匀附着KI粉末,其作用是
(4)E装置的作用是
A、收集气体 B、吸收氯气 C、防止倒吸 D、吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出产生黑色小颗粒的化学方程式
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 D.CCl4
(7)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用
A.O2 B.Cl2 C.CO2 DHClO
(8)据报道,某年某月某日位于重庆市江北区的天原化工总厂相继发生氯气泄漏和爆炸事故.当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
A.NaOH B.NaCl C.KBr D.Na2CO3

考点:氯气的实验室制法,氯气的化学性质
专题:卤族元素
分析:(1)浓硫酸具有吸水性可以干燥氯气和氯化氢,得到的气体B中可以充分混合;
(2)甲烷和氯气发生取代反应,逐步取代甲烷中的氢原子,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳;
(3)氯气具有强的氧化性能够氧化碘化钾;
(4)反应后剩余的氯化氢气体能够污染空气,不能排放到空气中,需要吸收,氯化氢易溶于水需要放倒吸;
(5)C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,黑色颗粒为碳,说明有碳生成;
(6)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷;
(7)氯气能够与氢氧化钠溶液反应生成氯化钠和次氯酸钠、水;工业上将氯气通入石灰乳生成氯化钙、次氯酸钙和水来制备漂白粉,次氯酸酸性弱于碳酸,漂白粉放置在空气中生成碳酸钙和次氯酸,碳酸钙与盐酸反应生成二氧化碳气体;
(8)氯气能够与碱反应,应选择碱性溶液吸收氯气,但是不能用强碱,因为强碱具有腐蚀性.
(2)甲烷和氯气发生取代反应,逐步取代甲烷中的氢原子,产物为氯化氢和二氯甲烷、三氯甲烷和四氯化碳;
(3)氯气具有强的氧化性能够氧化碘化钾;
(4)反应后剩余的氯化氢气体能够污染空气,不能排放到空气中,需要吸收,氯化氢易溶于水需要放倒吸;
(5)C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,黑色颗粒为碳,说明有碳生成;
(6)甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;一氯甲烷是气体,还可能有过量的甲烷;
(7)氯气能够与氢氧化钠溶液反应生成氯化钠和次氯酸钠、水;工业上将氯气通入石灰乳生成氯化钙、次氯酸钙和水来制备漂白粉,次氯酸酸性弱于碳酸,漂白粉放置在空气中生成碳酸钙和次氯酸,碳酸钙与盐酸反应生成二氧化碳气体;
(8)氯气能够与碱反应,应选择碱性溶液吸收氯气,但是不能用强碱,因为强碱具有腐蚀性.
解答:
解:(1)生成的氯气中含有水蒸气,因浓硫酸具有吸水性,还具有干燥作用,所以B装置除具有控制气流速度、均匀混合气体之外,干燥混合气体;
故答案为:使气体混合均匀;干燥混合气体;
(2)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,当甲烷中氢原子全部被取代时生成的氯化氢最多,所以设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷中H被完全取代,x≥4;
故答案为:≥4;
(3)氯气具有强的氧化性能够氧化碘化钾,反应生成氯化钾和碘,所以D装置中的石棉上均匀附着KI粉末可以吸收过量的氯气;
故答案为:吸收过量的氯气;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,E装置在吸收氯化氢时可防止倒吸,
故答案为:CD;
(5)CH4与Cl2在强光照射下生成的黑色小颗粒为炭黑,所以在强光照射下可发生CH4+2Cl2
C+4HCl;
故答案为:CH4+2Cl2
C+4HCl;
(6))甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
一氯甲烷是气体,还可能有过量的甲烷,所以尾气的主要成分是可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液;ab.
(7)氯气能够与氢氧化钠溶液反应生成氯化钠和次氯酸钠、水,反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;工业上将氯气通入石灰乳生成氯化钙、次氯酸钙和水来制备漂白粉,漂白粉的主要成分为氯化钙与次氯酸钙,有效成分为次氯酸钙,次氯酸酸性弱于碳酸,漂白粉放置在空气中生成碳酸钙和次氯酸,碳酸钙与盐酸反应生成二氧化碳气体;
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O;Ca(ClO)2;C;
(8)氯气能够与碱反应,应选择碱性溶液吸收氯气,但是不能用强碱,因为强碱具有腐蚀性,碳酸钠属于强碱弱酸盐,水解显碱性,可以用来吸收氯气,氢氧化钠属于强碱,具有腐蚀性,能够腐蚀皮肤,氯化钠、溴化钠溶液为中性,
故选:D.
故答案为:使气体混合均匀;干燥混合气体;
(2)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,当甲烷中氢原子全部被取代时生成的氯化氢最多,所以设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应保证甲烷中H被完全取代,x≥4;
故答案为:≥4;
(3)氯气具有强的氧化性能够氧化碘化钾,反应生成氯化钾和碘,所以D装置中的石棉上均匀附着KI粉末可以吸收过量的氯气;
故答案为:吸收过量的氯气;
(4)装置中最后剩余的氯化氢气体需要吸收不能排放到空气中,氯化氢易溶于水需要防止倒吸,E装置在吸收氯化氢时可防止倒吸,
故答案为:CD;
(5)CH4与Cl2在强光照射下生成的黑色小颗粒为炭黑,所以在强光照射下可发生CH4+2Cl2
| 光照 |
故答案为:CH4+2Cl2
| 光照 |
(6))甲烷和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;其中一氯甲烷为气态,二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可用分液分开;
一氯甲烷是气体,还可能有过量的甲烷,所以尾气的主要成分是可能存在剩余的甲烷和生成的一氯甲烷等气体,应进行尾气处理,
故答案为:分液;ab.
(7)氯气能够与氢氧化钠溶液反应生成氯化钠和次氯酸钠、水,反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;工业上将氯气通入石灰乳生成氯化钙、次氯酸钙和水来制备漂白粉,漂白粉的主要成分为氯化钙与次氯酸钙,有效成分为次氯酸钙,次氯酸酸性弱于碳酸,漂白粉放置在空气中生成碳酸钙和次氯酸,碳酸钙与盐酸反应生成二氧化碳气体;
故答案为:NaOH;Cl2+2NaOH=NaCl+NaClO+H2O;Ca(ClO)2;C;
(8)氯气能够与碱反应,应选择碱性溶液吸收氯气,但是不能用强碱,因为强碱具有腐蚀性,碳酸钠属于强碱弱酸盐,水解显碱性,可以用来吸收氯气,氢氧化钠属于强碱,具有腐蚀性,能够腐蚀皮肤,氯化钠、溴化钠溶液为中性,
故选:D.
点评:本题考查了氯气的制备和性质的检验,题目难度不大,明确反应原理和氯气的性质是解题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式表示正确的是( )
| A、AgNO3溶液中加入Cu:Cu+Ag+═Cu2++Ag |
| B、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C、醋酸溶液滴到大理石台板上有气泡产生:2H++CaCO3═CO2↑+Ca2++H2O |
| D、等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
在天平的两个托盘上,放上质量相等的两个烧杯,在烧杯中分别加入等质量等浓度的硫酸,此时天平处于平衡状态,然后分别向两只烧杯中加入等质量的Na2CO3和NaHCO3粉末,完全反应后,则天平两边( )
| A、放Na2CO3的一端托盘下沉 |
| B、NaHCO3的一端托盘下沉 |
| C、仍保持平衡 |
| D、无法判断 |
下列说法不正确的是( )
| A、利用“地沟油”可制得肥皂 |
| B、含碳原子数不同的烷烃均互为同系物 |
| C、甲烷与氯气按照物质的量之比1:3充入试剂瓶中,光照充分反应后生成物为氯仿 (CHCl3)和HCl |
| D、CHCl2-CH3不可能为CH2=CH2的加成产物 |
下列说法错误的是( )
| A、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率可用同一原理来解释 |
| B、已知FeS与某浓度的HNO3反应时生成Fe(NO3)3、H2SO4和某一单一的还原产物,若FeS和参与反应的HNO3的物质的量之比为1:6,则该反应的还原产物是NO |
| C、已知14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
| D、铁在少量氯气或过量的氯气中点燃所得产物不相同 |
X元素原子最外层有7个电子.Y元素的原子和X元素的原子次外层都有8个电子.在X与Y形成的离子化合物中,阴、阳离子的电子层结构相同.则X与Y形成的化合物的化学式是( )
| A、NaF |
| B、MgCl2 |
| C、NaCl |
| D、CaCl2 |
下列关于碱金属的原子结构和性质的叙述中不正确的是( )
| A、碱金属原子最外层都只有1个电子,在化学反应中容易失去最外层这个电子 |
| B、都是强还原剂 |
| C、都能在O2中燃烧生成过氧化物 |
| D、都能与水反应生成碱 |