题目内容
1.已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12.在只含有KCl、K2CrO4的混合溶液中滴加0.001mol•L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol•L-1,此时溶液中Cl-的物质的量浓度是( )| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |
分析 根据溶解度的计算,首先根据Ksp(Ag2CrO4)求算Ag+浓度,Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42?),代入数据可得c(Ag+),最后求出c(Cl?).
解答 解:首先根据Ksp(Ag2CrO4)求算Ag+浓度,Ksp(Ag2CrO4)=c2(Ag+)•c(CrO42?),代入数据可得c(Ag+)=2×10-5mol•L?1,则c(Cl?)=Ksp(AgCl)÷c(Ag+)=8.90×10-6 mol•L?1,
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析、计算能力的考查,本题注意把握向计算公式的运用,难度不大.

练习册系列答案
相关题目
18.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下叙述正确的是( )
| A. | 植物油不能使溴水褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质遇到硫酸铜后产生的沉淀能重新溶于水 |
19.下列叙述中,正确的是( )
| A. | 胶体属于介稳体系 | |
| B. | 蒸发操作中主要仪器是坩埚 | |
| C. | 粗盐经过溶解、过滤、蒸发后得到的是纯净的食盐 | |
| D. | NH4NO3不属于盐 |
16.NA为阿伏加德罗常数,下列物质的物质的量最小的是( )
| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
6.已知:I2+2S2O32═S4O62-+2I-.相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①CuCl2溶液与KI反应的离子方程式为2Cu2++4I-═2CuI↓+I2.
②该试样中CuCl2•2H2O的质量百分数为95%.
10.已知反应:H2(g)+I2(g)?2HI(g)△H=-11kJ/mol,在443℃时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表.(已知:正反应速率为v正=k正•x(H2)•x(I2),逆反应速率为v逆=k逆•x2(HI),其中k正、k逆为速率常数),下列不正确的是( )
| t/min | 平衡时的热量变化 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| 第一组 | X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | 放出Q1kJ |
| 第二组 | X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 吸收Q2kJ |
| A. | Q1+Q2=11a(a>0) | |
| B. | k正=K•k逆(K为已知反应的平衡常数,下同) | |
| C. | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D. | 相同温度下,在第二组平衡后的混合气体中再加入2molHI,重新达到平衡后,HI的转化率为21.6% |
11.下列叙述正确的是( )
| A. | 常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大 | |
| B. | 常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b | |
| C. | 若将适量CO2通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| D. | 常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka•Kh=Kw |
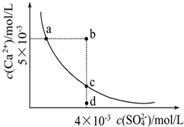 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列叙述正确的是