题目内容
16.NA为阿伏加德罗常数,下列物质的物质的量最小的是( )| A. | 标准状况下2.24L O2 | |
| B. | 含NA个氢分子的H2 | |
| C. | 8.5g氨气(氨气的摩尔质量为17g•mol-1) | |
| D. | 含3.01×1022个分子的CH4 |
分析 依据n=$\frac{m}{M}$=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$计算解答.
解答 解:A.标准状况下2.24L O2,物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol;
B.含NA个氢分子的H2的物质的量为1mol;
C.8.5g氨气物质的量为$\frac{8.5g}{17g/mol}$=0.5mol;
D.含3.01×1022个分子的CH4,物质的量为$\frac{3.01×10{\;}^{22}}{6.02×10{\;}^{23}mol{\;}^{-1}}$=0.05mol;
所以物质的物质的量最小的是:D.
故选:D.
点评 本题考查了以物质的量为核心的计算,明确相关计算公式是解题关键,题目难度不大.

练习册系列答案
相关题目
6.已知1gN2含a个分子,则阿伏加德罗常数为( )
| A. | $\frac{a}{14}$ mol-1 | B. | $\frac{a}{28}$ mol-1 | C. | 14a mol-1 | D. | 28a mol-1 |
7.在一密闭容器中,反应m A(g)+n B(g)?3C(g)达到平衡时,测得c(A)=0.5mol/L.在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.3mol/L.下列判断中正确的是( )
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增大 |
4.浓度均为0.1mol•L-1的下列各组溶液,pH前者大于后者的是( )
| A. | NaH2PO4、Na2HPO4 | B. | Na2CO3、NaHCO3 | C. | NaHSO4、NaHCO3 | D. | Na2SO4、CH3COONa |
1.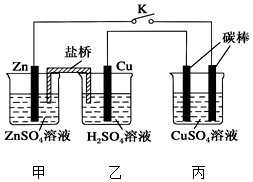 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
 用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )
用如图所示的装置进行实验,反应一段时间后断开K,向丙烧杯中加入0.1mol CuO后,CuSO4溶液恰好恢复到反应前的浓度.下列说法中不正确的是( )| A. | 乙烧杯中铜棒为正极,其电极反应式为2H++2e-═H2↑ | |
| B. | 丙烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应时盐桥中的阴离子向甲烧杯移动 | |
| D. | 导线中通过电子的物质的量为0.1 mol |
1.已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12.在只含有KCl、K2CrO4的混合溶液中滴加0.001mol•L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol•L-1,此时溶液中Cl-的物质的量浓度是( )
| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |