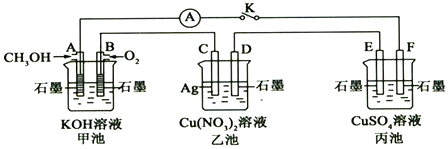
题目内容
12.下列有关金属钠及其化合物的说法中,错误的是( )| A. | Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 | |
| B. | 钠应保存于煤油中 | |
| C. | 钠投入滴有紫色石蕊试液的水中,溶液呈现红色 | |
| D. | 钠的焰色为黄色 |
分析 A、Na2O是白色固体;
B、钠是活泼金属,不能和空气接触,密度比煤油大,可以放入煤油中保存;
C、钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性;
D、钠的焰色反应是黄色.
解答 解:A、Na2O是白色固体,和水反应生成NaOH,是碱性氧化物,故A错误;
B、钠是活泼金属,不能和空气接触,密度比煤油大,少量钠可以放入煤油中保存,故B正确;
C、钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色,不是红色,故C错误;
D、钠的焰色反应是黄色,注意焰色反应是元素的性质,故D正确;
故选AC.
点评 本题考查了钠及其化合物性质的分析应用,注意基础知识的积累,题目较简单.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
15.下列仪器名称为“镊子”的是( )
| A. |  | B. |  | C. |  | D. |  |
20.研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域.已知CO2溶于海水主要以4种无机碳形式存在,其中HCO3-占95%,请按要求回答:
(1)CO2溶于水转化为HCO3-的方程式为:CO2+H2O?H2CO3,H2CO3?HCO3-+H+,对于此过程能说明已经达到平衡状态的是BD
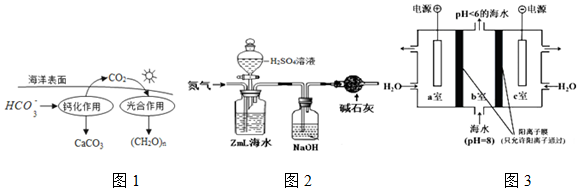
A.混合体系中的碳总量保持不变 B.混合液的pH保持不变
C.HCO3-与H2CO3的浓度相等 D.HCO3-的百分含量保持不变
(2)在海洋循环中,通过如图1所示的途径固碳.写出钙化作用的离子方程式:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2.用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图2),该装置中干燥管的作用是防止空气中的二氧化碳进入被氢氧化钠溶液吸收.
②滴定.若Z mL海水中的无机碳恰好使NaOH吸收液完全转化为200mL的NaHCO3溶液,再用ymol/L的标准盐酸溶液滴定,有关数据记录如表:
根据相关数据,计算海水中溶解的无机碳的浓度$\frac{200y}{Z}$mol/L
(4)利用如图3所示装置从海水中提取CO2,有利于减少环境温室气体含量,结合方程式简述提取CO2的原理a室:2H2O-4e=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O.
(1)CO2溶于水转化为HCO3-的方程式为:CO2+H2O?H2CO3,H2CO3?HCO3-+H+,对于此过程能说明已经达到平衡状态的是BD

A.混合体系中的碳总量保持不变 B.混合液的pH保持不变
C.HCO3-与H2CO3的浓度相等 D.HCO3-的百分含量保持不变
(2)在海洋循环中,通过如图1所示的途径固碳.写出钙化作用的离子方程式:2HCO3-+Ca2+=CaCO3↓+CO2↑+H2O.
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2.用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如图2),该装置中干燥管的作用是防止空气中的二氧化碳进入被氢氧化钠溶液吸收.
②滴定.若Z mL海水中的无机碳恰好使NaOH吸收液完全转化为200mL的NaHCO3溶液,再用ymol/L的标准盐酸溶液滴定,有关数据记录如表:
| 测定序号 | NaHCO3溶液的体积/mL | 盐酸标准液滴定管中的读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 1.50 | 21.52 |
| 2 | 20.00 | 1.80 | 25.62 |
| 3 | 20.00 | 0.20 | 20.18 |
(4)利用如图3所示装置从海水中提取CO2,有利于减少环境温室气体含量,结合方程式简述提取CO2的原理a室:2H2O-4e=4H++O2↑,氢离子通过阳离子交换膜进入b室,发生反应:H++HCO3-=CO2↑+H2O.
7.下列反应中,需要加入氧化剂才能发生的是( )
| A. | HNO3→NO | B. | H2SO4 (浓)→SO2 | C. | I-→I2 | D. | Br2→Br- |
4.下列化学反应中,属于氧化还原反应的是( )
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | 2NaHCO3═Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
1.实验室需配制500mL 0.4mol/L Na2SO4溶液,请你参与实验过程,并完成相关实验报告(填写表格中横线上数字序号所示内容).
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质Na2SO4固体的质量为28.4g. (2)称量:用托盘天平称取所需Na2SO4固体. (3)溶解:将称好的Na2SO4固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液冷却至室温并注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,该同学所配置溶液是浓度=(填“>”、“=”或“<”)0.4mol/L. |
2.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 1.8gNH4+中含有的电子数为1.1NA | |
| B. | 2.2gCO2和N2O的混合气体中原于数为0.15NA | |
| C. | 1molNa2O2与足量CO2反应,转移电子数为2NA | |
| D. | 25℃、101kPa时,2.24LCH4含有的共价键数为0.4NA |