题目内容
17.某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转.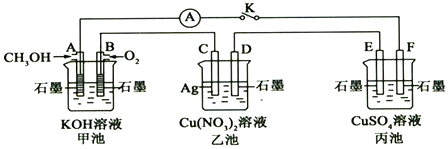
请回答下列问题:
(1)甲池为原电池(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(2)丙池中F电极为阴极(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为,2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑.
(3)当乙池中C极质量减轻5.4g时,甲池中B电极理论上消耗O2的体积为280mL(标准状况).
(4)一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是A(填选项字母).
A.Cu B.CuO C.Cu(OH)2 D.Cu2(0H)2CO3.
分析 甲池为燃料电池,A为负极,B为正极,则乙中C为阳极,D为阴极,阳极上Ag失电子生成银离子,阴极上铜离子得电子生成Cu,丙池中E为阳极,F是阴极,也就是惰性电极电解硫酸结合溶液中离子变化分析.
解答 解:(1)甲池为原电池,A电极的电极反应式为原电池,A为CH3OH发生氧化反应,电极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:原电池;CH3OH+8OH--6e-=CO32-+6H2O;
(2)丙池中F电极为阴极,电解硫酸铜溶液的方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2SO4+2Cu+O2↑,故答案为:阴极,2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2H2SO4+2Cu+O2↑;(3)根据转移电子数目相等,4Ag~~O2,
4×108g 22400mL
5.4g V
所以V=$\frac{22400×5.4}{4×108}$=280,解之得:V=280mL,故答案为:280;
(4)甲池为燃料电池,A为负极,B为正极,则乙中C为阳极,D为阴极,阳极上Ag失电子生成银离子,阴极上铜离子得电子生成Cu,溶液中减少了Cu元素的质量,所以要让电解质复原,需要加入金属铜,故选:A.
点评 本题考查了原电池原理和电解池原理的应用,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力,注意把握原电池和电解池中电极的判断以及电极上发生的反应.

 阅读快车系列答案
阅读快车系列答案| A. | 质子数为53,中子数为78的碘原子:53131I | |
| B. | CH4分子的比例模型: | |
| C. | Na+ 的结构示意图: | |
| D. | NaOH的电离方程式:NaOH?Na++OH- |
I.配制溶液(以NaOH溶液为例)
(1)实验需要0.5mol/L NaOH溶液245mL,则至少需要NaOH固体5.0g.
(2)配制NaOH溶液过程中,一定需要下列仪器中的填写仪器的标号)如图21
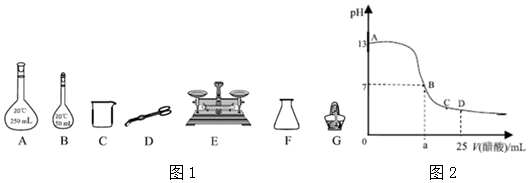
II.测定NaOH溶液与稀 H2SO4反应的中和热 取50mLNaOH溶液与30mL H2SO4溶液进行实验,测得数据如表:
| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 25.0 | 24.5 | 24.75 | 29.3 | 4.55 |
| 2 | 24.5 | 24.2 | 24.35 | 28.3 | 3.95 |
| 3 | 25.0 | 24.5 | 24.75 | 28.7 | 3.95 |
(4)上述实验计算结果与一57.3kJ/mol存在偏差的原因可能是ACD(填序号)
A.实验装置保温、隔热效果差
B量取NaOH溶液体积时仰视读数
C.分多次将NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后,直接测定H2S04溶液的温度
III.向25mLNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,滴定曲线如图所示:
(5)写出NaOH溶液与CH3COOH溶液反应的离子方程式CH3COOH+OH-=CH3COO-+H2O.
(6)该NaOH溶液的物质的量浓度为0.1mol/L.
(7)当滴加CH3COOH溶液至D点时,所得混合溶 液中各离子浓度的大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
| A. | Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 | |
| B. | 钠应保存于煤油中 | |
| C. | 钠投入滴有紫色石蕊试液的水中,溶液呈现红色 | |
| D. | 钠的焰色为黄色 |
| A. | SO2、SiO2、CO均为酸性氧化物 | B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | ||
| C. | 硫酸、盐酸、氢氟酸均为强酸 | D. | 氯水、水玻璃、氨水均为混合物 |
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,浓H2SO4与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ/mol |
| A. | 苯与液溴FeBr3作催化剂的条件下发生取代反应,生成溴苯 | |
| B. | 分子式为C5H10Q2,且能与NaHCO3反应的有机物有3种 | |
| C. | 乙醇制备乙烯和乙醇制备乙酸乙酯均为取代反应 | |
| D. | 2-甲基戊烷和4-甲基戊烷互为同分异构体 |