题目内容
4.下列化学反应中,属于氧化还原反应的是( )| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | 2NaHCO3═Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
分析 氧化还原反应的实质为电子转移、特征为化合价升降,所以氧化还原反应中一定存在元素化合价变化,据此对各选项进行判断.
解答 解:A.Na2CO3+CaCl2═CaCO3↓+2NaCl为复分解反应,不存在化合价变化,不属于氧化还原反应,故A错误;
B.Fe+CuSO4═Cu+FeSO4为置换反应,Al、Fe元素的化合价发生变化,属于氧化还原反应,故B正确;
C.2NaHCO3═Na2CO3+CO2↑+H2O为分解反应,反应中不存在化合价变化,不属于氧化还原反应,故C错误;
D.CaO+H2O═Ca(OH)2为化合反应,不存在化合价变化,不属于氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应的判断,题目难度不大,明确氧化还原反应的实质、特征为解答关键,注意掌握四种基本反应类型与氧化还原反应之间的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 石油的分馏和煤的液化都是发生了物理变化 | |
| B. | 乙烯和乙炔都能与溴水发生加成反应且生成的产物相同 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色 |
15.如图是一些常见有机物的转化关系,关于反应①~⑦的说法不正确的是( )
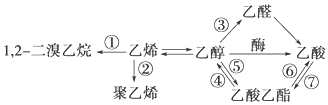

| A. | 反应①是加成反应 | B. | 只有反应②是加聚反应 | ||
| C. | 只有反应⑦是取代反应 | D. | 反应③是氧化反应 |
12.下列有关金属钠及其化合物的说法中,错误的是( )
| A. | Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 | |
| B. | 钠应保存于煤油中 | |
| C. | 钠投入滴有紫色石蕊试液的水中,溶液呈现红色 | |
| D. | 钠的焰色为黄色 |
19.下列说法正确的是( )
| A. | 根据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| B. | 强、弱电解质的本质区别是溶解度的大小不同 | |
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀 | |
| D. | 室温下,在蒸馏水中滴入少量盐酸后,溶液的PH增大 |
16.已知:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-1451.6kJ•mol-1.下列叙述正确的是( )
| A. | 该反应是吸热反应 | |
| B. | 2mol甲醇所具有的能量是1451.6 kJ | |
| C. |  如图是CH3OH(l)燃烧反应过程的能量变化示意图 | |
| D. | 25℃、101kPa时,1 mol甲醇完全燃烧生成CO2和液态水,同时放出725.8 kJ热量 |
14. 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )| A. | CH2C12有两种同分异构体 | |
| B. | 丙烯能使溴水褪色 | |
| C. | 戊醇在一定条件下能与乙酸发生酯化反应 | |
| D. | 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷 |