题目内容
2.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )| A. | 1.8gNH4+中含有的电子数为1.1NA | |
| B. | 2.2gCO2和N2O的混合气体中原于数为0.15NA | |
| C. | 1molNa2O2与足量CO2反应,转移电子数为2NA | |
| D. | 25℃、101kPa时,2.24LCH4含有的共价键数为0.4NA |
分析 A.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合1个铵根离子含有10个电子解答;
B.二氧化碳与一氧化二氮的摩尔质量相同,都是三原子分子;
C.Na2O2固体与CO2反应时为歧化反应;
D.25℃、101kPa时,非标准状况,Vm≠22.4L/mol;
解答 解:A.1.8gNH4+中含有的电子数为$\frac{1.8g}{18g/mol}$×10×NA=NA,故A错误;
B.2.2gCO2和N2O的混合气体中原于数为$\frac{2.2g}{44g/mol}$×3×NA=0.15NA,故B正确;
C.Na2O2固体与CO2反应时为歧化反应,1mol过氧化钠转移1mol电子即NA个,故C错误;
D.25℃、101kPa时,不是标准状况,Vm未知,无法计算甲烷的物质的量,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数的有关计算及应用,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列有关金属钠及其化合物的说法中,错误的是( )
| A. | Na2O是淡黄色固体,和水反应生成NaOH,是碱性氧化物 | |
| B. | 钠应保存于煤油中 | |
| C. | 钠投入滴有紫色石蕊试液的水中,溶液呈现红色 | |
| D. | 钠的焰色为黄色 |
17.NA为表阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 9 g38903Sr2+中含有的电子数为3.6 NA | |
| B. | 某温度下纯水的pH=6,该温度下1L pH=11的NaOH溶液中含OH-的数目为0.1NA | |
| C. | 一定温度下,1 L 0.5 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1NH4Cl溶液含NH4+均为0.5NA | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
7.下列有关有机化合物的说法正确的是( )
| A. | 苯与液溴FeBr3作催化剂的条件下发生取代反应,生成溴苯 | |
| B. | 分子式为C5H10Q2,且能与NaHCO3反应的有机物有3种 | |
| C. | 乙醇制备乙烯和乙醇制备乙酸乙酯均为取代反应 | |
| D. | 2-甲基戊烷和4-甲基戊烷互为同分异构体 |
14. 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖.轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是( )| A. | CH2C12有两种同分异构体 | |
| B. | 丙烯能使溴水褪色 | |
| C. | 戊醇在一定条件下能与乙酸发生酯化反应 | |
| D. | 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷 |
11.将一小块钠放入下列溶液时,不会出现沉淀的是( )
| A. | 氯化镁溶液 | B. | 饱和氢氧化钠溶液 | ||
| C. | 硫酸 | D. | 硫酸铜溶液 |
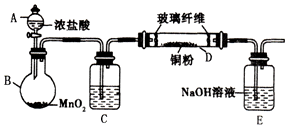 实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).
实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去).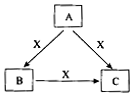 A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
A、B、C、X是中学化学常见化合物,均由短周期元素组成,转化关系如图所示. 若A、B、C的焰色反应均呈黄色,水溶液均为碱性.