��Ŀ����
11����1��CO��g��+2H2��g��?CH3OH��g����H������������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
A����ϵ��ѹǿ���� B���ܶȲ��� C������������Է������� D��c��CO��=c��CH3OH��
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ10min�ﵽƽ��ʱ���c��CO��=0.2mol/L��������¶��µ�ƽ�ⳣ��K=2.041������3Ϊ��Ч���֣�
��2����ij�¶Ⱥ�ѹǿ�£���һ����H2��O2�����ܱ�����������Ӧ��
2H2��g��+O2��g��?2H2O��g����H=-241.8KJ/mol��ƽ���ѹ�����������ԭ����$\frac{1}{2}$�������������䣬��ƽ����ϵ������Ӱ����c ������ţ���
a��ƽ�ⳣ��K���� b������Ӧ���ʼӿ죬�淴Ӧ���ʼ����� c������ƽ��c��H2��/c��H2O����С��
���� ��1�����ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ������淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�ͬ�����ʣ������淴Ӧ����֮�ȵ���ϵ��֮�ȣ���ͬ���ʣ���ƽ��ʱ�������ʵ����ʵ�����Ũ�ȵȲ��ٷ����仯���ɴ�������һЩ���������䣻
�ڸ���ƽ��Ũ�ȼ����ƽ�ⳣ����
��2��ƽ���ѹ�����������ԭ����$\frac{1}{2}$��ѹǿ����Ӧ��������ƽ�������ƶ��������ʲ��䣬��ƽ�ⳣ�����䣮
��� �⣺��1�����ɱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����H��0��
A����Ӧǰ��������ȣ�����ϵ��ѹǿ���䣬��˵���ﵽƽ��״̬����A��ȷ��
B����Ӧ����������䣬�����������䣬���ܶȲ��䲻��˵���ﵽƽ�⣬��B����
C����Ӧǰ����������ʵ������ȣ�����������Է����������䣬��˵���ﵽƽ��״̬����C��ȷ��
D��c��CO��=c��CH3OH��������˵���ﵽƽ��״̬����ƽ�ⳣ���Լ�������Ũ��δ֪����D����
�ʴ�Ϊ������AC��
��CO��g��+2H2��g��?CH3OH��g����λΪmol/L
��Ӧ��ʼ 1mol/L 3mol/L 0
��Ӧ 0.8mol/L 1.6mol/L 0.8mol/L
ƽ�� 0.2mol/L 1.4mol/L 0.8mol/L
ƽ�ⳣ��K=$\frac{0.8}{0.2��1��{4}^{2}}$=2.041��
�ʴ�Ϊ��2.041��
��2��a�����¶Ȳ��䣬��ƽ�ⳣ��K���䣬��a����
b������ѹǿ�����淴Ӧ���ʶ�����b����
c��ƽ�������ƶ���������ƽ��c��H2��/c��H2O����С����c��ȷ��
�ʴ�Ϊ��c��
���� ���⿼�黯ѧƽ����㼰��ѧƽ��״̬�жϣ�Ϊ��Ƶ���㣬���ؿ���ѧ���Ի�ѧƽ��״̬���������⼰��ѧƽ��֪ʶ��������ã���������ʽ�������ע�⣺���㻯ѧƽ�ⳣ��ʱ������ƽ��ʱ������Ũ�ȣ���������ʱ��Ũ�ȣ�

������±�㶹�� ���������ܴ����ٲ��˳�Ѫ��
����������ˮ ���ܽ����뺣���γ������ޣ�
| A�� | ֻ�Т٢� | B�� | ֻ�Т٢ڢ��о��� | C�� | ֻ�Т٢ڢ� | D�� | ȫ�� |
| A�� | �÷�Һ©�����ƾ���ˮ���� | |
| B�� | ����ɫ��Ӧ����Na2SO4��Na2CO3 | |
| C�� | ��NaOH ��Һ��ȥCl2�л��е�����HCl | |
| D�� | �����ղ�����ζ��ȷ����ά�Ƿ��ǵ�������ά |
 ˮ��������ԴȪ����ҵ��ѪҺ�����е�������Ҫ�����ú�������ˮ����Ҫ������ˮԴ����Ⱦ��ͨ����ˮֱ�Ӷ������壬Ҳ��ͨ��ʳ�������ũ����Σ�����������ʴ��������⣺
ˮ��������ԴȪ����ҵ��ѪҺ�����е�������Ҫ�����ú�������ˮ����Ҫ������ˮԴ����Ⱦ��ͨ����ˮֱ�Ӷ������壬Ҳ��ͨ��ʳ�������ũ����Σ�����������ʴ��������⣺��1��25��ʱ����ˮ�ĵ���ƽ����ϵ�м�������̼���ƹ��壬�õ�pHΪ11����Һ����ˮ������ӷ���ʽΪCO32-+H2O?HCO3-+OH-��HCO3-+H2O?H2CO3+OH-����ˮ�����c��OH-��=0.001mol•L-1��
��2����ˮ��100��ʱ��pH=6�����¶���1mol��L-1��NaOH��Һ�У���ˮ�������c��OH-��=10-12mol•l-1
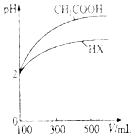
��3�������Ϊ100mL��pH��Ϊ2��CH3COOH��Һ��һԪ��HX��Һ����ˮϡ������pH������Ĺ�ϵ��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��С�ڣ�����ڡ���С�ڡ����ڡ���CH3COOH�ĵ���ƽ�ⳣ����
��4������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ���������ã���֪��
| ��ѧʽ | ����ƽ�ⳣ����25�棩 |
| HCN | K=4.9��10-10 |
| CH3COOH | K=1.8��10-5 |
| H2CO3 | K1=4.3x10-7��K2=5.6��10-11 |
����NaCN��Һ��ͨ��������CO2��������Ӧ��ѧ����ʽΪNaCN+H2O+CO2=HCN+NaHCO3��
��5��25��ʱ����CH3COOH��CH3COONa�Ļ����Һ�У������pH=6������Һ��CH3COO-��•c��Na+��=9.9��10-7���ȷֵ��mol•L-1��
��©�����Թܢ�������ƿ����ƽ�ݷ�Һ©��������ƿ���������������
| A�� | �٢ۢݢ� | B�� | �٢ڢܢ� | C�� | �٢ۢݢ� | D�� | �٢ۢݢ� |
H2S��g��+$\frac{3}{2}$O2��g���TSO2��g��+H2O��g����H12H2S��g��+SO2��g���T$\frac{3}{2}$S2��g��+2H2O��g����H2
2H2S��g��+O2��g���T2 S��g��+2H2O��g����H32S��g���TS2��g����H4
���H4����ȷ����ʽΪ��������
| A�� | ��H4=$\frac{2}{3}$ ��3��H3-��H1��-��H2 | B�� | ��H4=$\frac{2}{3}$ ����H1+��H2��+��H3 | ||
| C�� | ��H4=$\frac{2}{3}$ ����H1+��H2��-��H3 | D�� | ��H4=$\frac{2}{3}$ ����H1-��H2��-��H3 |
| A�� | �����¶ȣ�ƽ�ⳣ��K��� | |
| B�� | ����ѹǿ��W��g�����ʵ���������� | |
| C�� | ���£�����������ƽ����Է���������С��������Ӧ���� | |
| D�� | ����XŨ�ȣ�ƽ��������Ӧ�����ƶ� |
