题目内容
4.银及其化合物在制造钱币、装饰器皿、电子电器、医药等方面具有广泛用途.回答下列问题:(1)银质器皿日久表面会逐渐变黑,这是银器接触含有H2S的空气生成了Ag2S的缘故,该反应的还原剂与还原产物的物质的量之比为2:1.在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑银器变亮,反应的化学方程式为3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓,食盐水的作用为作电解质溶液.
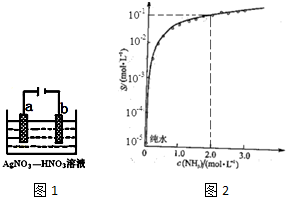
(2)图1为电解精炼银的示意图,a(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
(3)已知Ag2CrO4为砖红色沉淀,Ksp(Ag2CrO4)=1×10-12,Ksp(AgCl)=1.8×10-10,在Cl-浓度为0.010mol/L,CrO42-浓度为5.0×10-3mol/L.用0.010mol/LAgNO3标准溶液进行滴定,当开始产生砖红色沉淀时,通过计算说明Cl-是否完全沉淀?
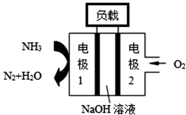
(4)AgCl溶于氨水:AgCl+2NH3?Ag(NH3)2++Cl-,平衡常数为K1.室温时,AgCl(s)的溶解度与氨水的起始浓度关系如图2:
①随着c(NH3)增大,AgCl的溶解度开始有明显增大,然后增大较小,原因是开始溶液中c[Ag(NH3)2+]和c(Cl-)很小,当c(NH3)增大,平衡向右移动程度大,所以AgCl的溶解度有明显增大;随着溶解的进行,溶液中c[Ag(NH3)2+]和c(Cl-)增大,对 $\frac{K_1}{{{K_{sp}}(AgCl)}}$正反应抑制程度大,当c(NH3)继续增大,平衡向右移动程度减小,所以AgCl的溶解度增大较小
②若氨水起始浓度c(NH3)=2.0mol/L,AgCl在氨水中达到溶解平衡时c平衡(NH3)=1.8mol/L.
③反应Ag++2NH3?Ag(NH3)2+的平衡常数K2的计算式为$\frac{{K}_{1}}{Ksp(AgCl)}$=$\frac{0.1×0.1}{1.8×1{0}^{-10}×1.{8}^{2}}$.
(5)含Ag(NH3)2+溶液可以吸收有毒的CO,生成微小黑色银颗粒,放出的气体既能使澄清石灰水变浑浊,又能使明矾溶液产生白色胶状沉淀,写出该反应的离子方程式2Ag(NH3)2++CO+H2O=2Ag+CO2↑+2NH4++2NH3↑.
分析 (1)根据银器接触含有H2S的空气生成了Ag2S书写氧化还原反应方程式,据此判断还原剂与还原产物的物质的量之比;根据铝、Ag2S以及食盐水构成原电池分析;
(2)电解精炼银时,粗银作阳极,若b极有少量红棕色气体生成,则b电极上硝酸根离子得电子生成二氧化氮;
(3)根据Ksp(Ag2CrO4)=1×10-12计算当开始产生砖红色沉淀时计算溶液中银离子浓度,再根据Ksp(AgCl)=1.8×10-10判断Cl-是否完全沉淀;
(4)①开始溶液中c[Ag(NH3)2+]和c(Cl-)很小,当c(NH3)增大,平衡向右移动程度大,所以AgCl的溶解度有明显增大;随着溶解的进行,溶液中c[Ag(NH3)2+]和c(Cl-)增大,对$\frac{K_1}{{{K_{sp}}(AgCl)}}$正反应抑制程度大;
②若氨水起始浓度c(NH3)=2.0mol/L,图象可知,氨气难度为2.0mol/L,溶解的AgCl浓度为0.1mol/L,消耗的氨气为0.2mol/L,结合三行计算列式计算得到,
AgCl+2NH3?Ag(NH3)2++Cl-,
起始量(mol/L) 2.0 0 0
变化量(mol/L) 0.2 0.1 0.1
平衡量(mol/L) 1.8 0.1 0.1
③反应Ag++2NH3?Ag(NH3)2+的平衡常数K2=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$×$\frac{c(C{l}^{-})}{c(C{l}^{-})}$=$\frac{{K}_{1}}{Ksp(AgCl)}$;
(5)含Ag(NH3)2+溶液可以吸收有毒的CO,生成微小黑色银颗粒位银单质,放出的气体既能使澄清石灰水变浑浊为二氧化碳,又能使明矾溶液产生白色胶状沉淀是促进铝离子水解正向进行生成氢氧化铝沉淀;
解答 解:(1)银器接触含有H2S的空气生成了Ag2S,则反应方程式为4Ag+2H2S+O2=2Ag2S+2H2O,则Ag为还原剂,氧气为氧化剂,生成H2O为还原产物,所以该反应的还原剂与还原产物的物质的量之比为2:1;
在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑银器变亮,则铝、Ag2S以及食盐水构成原电池,其中铝能还原出银,同是生成氢氧化铝和硫化氢,反应的方程式为 3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓,食盐水的作用为作电解质溶液;
故答案为:2:1; 3Ag2S+2Al+6H2O=6Ag+3H2S↑+2Al(OH)3↓;作电解质溶液;
(2)电解精炼时,粗银做阳极,所以粗银是a极;b电极是阴极,发生还原反应,生成了红棕色气体是NO2,电极反应:NO3-+e-+2H+=NO2↑+H2O,
故答案为:a;NO3-+e-+2H+=NO2↑+H2O;
(3)析出沉淀时,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{K{\;}_{sp}(Ag{\;}_{2}CrO{\;}_{4})}{c(CrO{{\;}_{4}}^{2-})}}$=$\sqrt{\frac{1×10{\;}^{-12}}{5.0×10{\;}^{-3}}}$mol/L=$\sqrt{2}$×10-5,所以溶液中的c(Cl-)=$\frac{K{\;}_{sp}(AgCl)}{c(Ag{\;}^{+})}$=$\frac{1.8×10{\;}^{-10}}{\sqrt{2}×10{\;}^{-5}}$=1.6×10-5mol/L>6×10-5mol/L,则没有完全沉淀,
答:Cl-没有完全沉淀;
(4)AgCl溶于氨水:AgCl+2NH3?Ag(NH3)2++Cl-,平衡常数为K1,开始溶液中c[Ag(NH3)2+]和c(Cl-)很小,当c(NH3)增大,平衡向右移动程度大,所以AgCl的溶解度有明显增大;随着溶解的进行,溶液中c[Ag(NH3)2+]和c(Cl-)增大,对$\frac{K_1}{{{K_{sp}}(AgCl)}}$正反应抑制程度大,当c(NH3)继续增大,平衡向右移动程度减小,所以AgCl的溶解度增大较小,
故答案为:开始溶液中c[Ag(NH3)2+]和c(Cl-)很小,当c(NH3)增大,平衡向右移动程度大,所以AgCl的溶解度有明显增大;随着溶解的进行,溶液中c[Ag(NH3)2+]和c(Cl-)增大,对$\frac{K_1}{{{K_{sp}}(AgCl)}}$正反应抑制程度大,当c(NH3)继续增大,平衡向右移动程度减小,所以AgCl的溶解度增大较小;
②若氨水起始浓度c(NH3)=2.0mol/L,图象可知,氨气难度为2.0mol/L,溶解的AgCl浓度为0.1mol/L,消耗的氨气为0.2mol/L,结合三行计算列式计算得到,
AgCl+2NH3?Ag(NH3)2++Cl-,
起始量(mol/L) 2.0 0 0
变化量(mol/L) 0.2 0.1 0.1
平衡量(mol/L) 1.8 0.1 0.1
故答案为:1.8mol/L;
③反应Ag++2NH3?Ag(NH3)2+的平衡常数K2=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$=$\frac{c(Ag(N{H}_{3}{)_{2}}^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$×$\frac{c(C{l}^{-})}{c(C{l}^{-})}$=$\frac{{K}_{1}}{Ksp(AgCl)}$=$\frac{0.1×0.1}{1.8×1{0}^{-10}×1.{8}^{2}}$,
故答案为:$\frac{{K}_{1}}{Ksp(AgCl)}$=$\frac{0.1×0.1}{1.8×1{0}^{-10}×1.{8}^{2}}$;
(5)含Ag(NH3)2+溶液可以吸收有毒的CO,生成微小黑色银颗粒位银单质,放出的气体既能使澄清石灰水变浑浊为二氧化碳,又能使明矾溶液产生白色胶状沉淀是碳酸根离子和铝离子双水解反应促进铝离子水解正向进行生成,反应的化学方程式为:2Ag(NH3)2++CO+H2O=2Ag+CO2↑+2NH4++2NH3↑,
故答案为:2Ag(NH3)2++CO+H2O=2Ag+CO2↑+2NH4++2NH3↑;
点评 本题考查了沉淀溶解平衡影响因素、溶度积常数计算、图象数据的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须大于水 | |
| B. | H2还原CuO时,先通H2后加热CuO,反应完毕后,先停止通H2后撤酒精灯 | |
| C. | 进行蒸馏操作时,冷凝管中的冷凝水应从下口进,上口出 | |
| D. | 当夜晚室内煤气泄漏时,先打开灯,再迅速开窗通气 |
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 单质的还原性 A>B>D>C |
| A. | 油脂的主要成分是高级脂肪酸的甘油酯属于酯类 | |
| B. | 油脂易溶于水 | |
| C. | 天然油脂大多由混甘酯分子构成的混合物 | |
| D. | 脂肪里饱和烃基的相对含量较大,熔点 较高 |
 (1)已知
(1)已知 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: