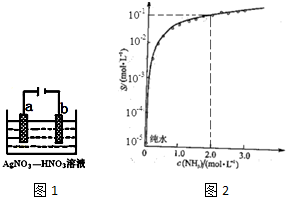
题目内容
9.下列实验操作,正确的是( )| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须大于水 | |
| B. | H2还原CuO时,先通H2后加热CuO,反应完毕后,先停止通H2后撤酒精灯 | |
| C. | 进行蒸馏操作时,冷凝管中的冷凝水应从下口进,上口出 | |
| D. | 当夜晚室内煤气泄漏时,先打开灯,再迅速开窗通气 |
分析 A.萃取时,萃取剂密度不一定大于原来溶剂;
B.先停止通H2后撤酒精灯时,Cu能和氧气反应生成CuO;
C.蒸馏操作时,冷凝管中的水采用逆流方式;
D.煤气遇明火、静电、电火花或加热易产生爆炸.
解答 解:A.萃取时,萃取剂密度不一定大于原来溶剂,如用苯萃取碘水中的碘,但苯密度小于水,故A错误;
B.先停止通H2后撤酒精灯时,Cu能和氧气反应生成CuO,为防止Cu被氧化,应该先撤酒精灯后停止通氢,故B错误;
C.蒸馏操作时,冷凝管中的水采用逆流方式,所以冷凝管中的冷凝水应从下口进,上口出,防止馏分急剧冷却而炸裂冷凝管,故C正确;
D.煤气遇明火、静电、电火花或加热易产生爆炸,所以当夜晚室内煤气泄漏时,不能开灯,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及实验操作、实验安全、试剂的选取等知识点,明确实验原理、实验操作规范性及物质性质是解本题关键,知道萃取剂选取方法,易错选项是C.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
4.下列分类正确的是( )
| A. | Na2O、Na2O2、Al2O3、CuO都是碱性氧化物 | |
| B. | 纯碱、烧碱均属碱类 | |
| C. | NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 | |
| D. | HCl、CH3COOH、HNO3都是强酸 |
1.下列化学用语正确的是( )
| A. | 羟基的电子式: | B. | 丙烷分子的比例模型: | ||
| C. | 1,3-丁二烯的分子式:C4H8 | D. | 甲酸甲酯的结构简式:C2H4O2 |
18.雾霾天气严重影响人们的身体健康,良好的生态环境可以提升生活质量.导致雾霾形成的主要污染物是( )
| A. | SO2 | B. | NO2 | C. | PM2.5 | D. | CO2 |
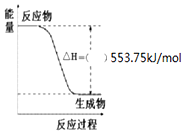 按要求写出298K、101kPa时下列反应的热化学方程式:
按要求写出298K、101kPa时下列反应的热化学方程式: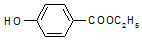 ,生产过程如图:
,生产过程如图: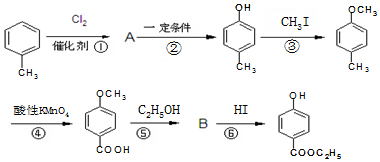
 .
. ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3.
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是-OH、-CH2OH 或-OCH3. .
.