题目内容
14. 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H 1
(1)已知:2CO(g)+O2(g)?2CO2(g);△H 2
2I2(s)+5O2(g)?2I2O5(s);△H 3
则△H 1=2.5△H2-0.5△H3(用含△H 2和△H 3的代数式表示).
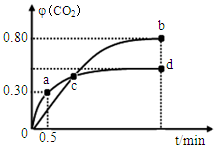
(2)不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图.请回答:
①c点正反应速率大于逆反应速率(填“大于”、“等于”或“小于”),a点逆反应速率小于d点逆反应速率(填“大于”、“等于”或“小于”)
②下列说法正确的是AB.(填字母序号)(双选)
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的平均相对分子质量相等
C.增加I2O5的投料量有利于提高CO的转化率
D.b点和d点的化学平衡常数:Kb<Kd.
分析 (1)已知:①2CO(g)+O2(g)?2CO2(g);△H 2
②2I2(s)+5O2(g)?2I2O5(s);△H 3
根据盖斯定律,①×$\frac{5}{2}$-②×$\frac{1}{2}$可得:5CO(g)+I2O5(s)?5CO2(g)+I2(s);
(2)①由图可知c未平衡,但CO2的体积分数变大,说明平衡正向移动;d点生成物的浓度大于a点生成物的浓度;
②A.所反应进行容器内气体质量增大,容器内气体密度增大,密度不变表明反应达到平衡状态;
B.两种温度下,c点时体系中二氧化碳的体积分数相等,而两种温度下体系中CO2、CO的物质的量之比相等;
C.I2O5为固体,增大其投料量不影响平衡移动;
D.平衡时b点二氧化碳体积分数大,由平衡常数表达式可知b点平衡常数更大.
解答 解:(1)已知:①2CO(g)+O2(g)?2CO2(g)△H 2
②2I2(s)+5O2(g)?2I2O5(s)△H 3
根据盖斯定律,①×$\frac{5}{2}$-②×$\frac{1}{2}$可得:5CO(g)+I2O5(s)?5CO2(g)+I2(s),则△H 1=2.5△H2-0.5△H3,
故答案为:2.5△H2-0.5△H3;
(2)①由图可知c未平衡,但CO2的体积分数变大,说明平衡正向移动,所以c点正反应速率大于逆反应速率;d点生成物的浓度大于a点生成物的浓度,所以a点逆反应速率小于d点逆反应速率,故答案为:大于;小于;
②A.所反应进行容器内气体质量增大,容器内气体密度增大,密度不变表明反应达到平衡状态,故A正确;
B.两种温度下,c点时体系中二氧化碳的体积分数相等,而两种温度下体系中CO2、CO的物质的量之比相等,则平均相对分子质量相等,故B正确;
C.I2O5为固体,增大其投料量不影响平衡移动,CO的转化率不变,故C错误;
D.平衡时b点二氧化碳体积分数大,由平衡常数表达式K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$;可知b点平衡常数更大,故D错误,
故选:AB.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、反应热计算等,需要学生熟练掌握基础知识并灵活应用.

已知:
①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=-2219.9kJ/mol.
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-.在电池内部O2-移动方向和在电池负极反应的物质分别是B
A.正极;O2 B.负极;C3H8C.正极;C3H8 D.负极;O2
(3)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO (g)+H2O(g)?CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是bd.
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
②T℃时,在1L的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如表:
| 时间/min | c(CO) | c(H2O)(g) | c(CO2) | c(H2) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
③已知420℃时,该化学反应的平衡常数为9.如果反应开始时CO和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为75%.又知397℃时该反应的平衡常数为12,请判断该反应的△H<0 (填“>”、“=”、“<”).
| A. | 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色 | |
| B. | 1 mol Na2O2与CO2和水蒸气的混合气体完全反应,转移1 mol电子 | |
| C. | 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3 | |
| D. | a g CO和CH4的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g |
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱均会“断路” |
| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的物质的量分数变小 | ||
| C. | 若a>b+c时,A的转化率不变 | D. | 若a<b+c时,A的转化率变小 |
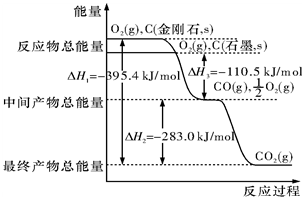 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示. .
.