题目内容
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1△H<0 (Ⅰ)
2NO(g)+Cl2(g)?2ClNO(g) K2△H<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= .其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”.若要使K2减小,可采用的措施是 .
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=0.25.
①t℃时,反应达到平衡时n(CO):n(CO2)= .
②若在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x= .
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1△H<0 (Ⅰ)
2NO(g)+Cl2(g)?2ClNO(g) K2△H<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)=
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=0.25.
①t℃时,反应达到平衡时n(CO):n(CO2)=
②若在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x=
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据化学平衡常数概念,结合反应化学方程式书写平衡常数,结合平衡常数表达式计算得到平衡常数关系;
(2)依据平衡三段式列式计算,依据反应速率概念计算V=
、转化率概念的计算,转化率=
×100%,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
(3)①依据平衡常数计算分析,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
②利用化学平衡三段式列式,结合平衡常数计算.反应前后气体物质的量相同,平衡常数计算利用物质的量代替平衡浓度计算得到.
(2)依据平衡三段式列式计算,依据反应速率概念计算V=
| △c |
| △t |
| 消耗量 |
| 起始量 |
(3)①依据平衡常数计算分析,利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
②利用化学平衡三段式列式,结合平衡常数计算.反应前后气体物质的量相同,平衡常数计算利用物质的量代替平衡浓度计算得到.
解答:
解:(1)①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g),△H1<0 (Ⅰ),平衡常数K1=
,
②2NO(g)+Cl2(g)?2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =
,
(1)③4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
,计算得到K=
,
故答案为:
;
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,物质的量为7.5×10-3mol?L-1?min-1×10min×2L=0.15mol,依据平衡三段式列式计算;
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol,
NO的转化率α1=
×100%=75%;
其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;
故答案为:0.025;75%;>;不变;升高温度;
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=0.25.
①t℃时,平衡常数K=
=0.25,则反应达到平衡时n(CO):n(CO2)=4:1,故答案为:4:1;
②若在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡,此时FeO(s)转化率为50%,依据化学平衡三段式列式得到;
FeO(s)+CO(g)?Fe(s)+CO2(g)
起始量(mol) x 0
变化量(mol) 0.01 0.01 0.01
平衡量(mol) x-0.01 0.01
K=
=0.25
则x=0.05mol
故答案为:0.05.
| c(ClNO) |
| c2(NO2) |
②2NO(g)+Cl2(g)?2ClNO(g),△H2<0 (Ⅱ),平衡常数K2 =
| c2(ClNO) |
| c2(NO)c(Cl2) |
(1)③4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
| c(Cl2)c2(NO) |
| c4(NO2) |
| K12 |
| K2 |
故答案为:
| K12 |
| K2 |
(2)在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,物质的量为7.5×10-3mol?L-1?min-1×10min×2L=0.15mol,依据平衡三段式列式计算;
2NO(g)+Cl2(g)?2ClNO(g),
起始量(mol) 0.2 0.1 0
变化量(mol) 0.15 0.075 0.15
平衡量(mol) 0.05 0.025 0.15
则平衡后n(Cl2)=0.025mol,
NO的转化率α1=
| 0.15mol |
| 0.2mol |
其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;
故答案为:0.025;75%;>;不变;升高温度;
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数K=0.25.
①t℃时,平衡常数K=
| c(CO2) |
| c(CO) |
②若在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡,此时FeO(s)转化率为50%,依据化学平衡三段式列式得到;
FeO(s)+CO(g)?Fe(s)+CO2(g)
起始量(mol) x 0
变化量(mol) 0.01 0.01 0.01
平衡量(mol) x-0.01 0.01
K=
| 0.01 |
| x-0.01 |
则x=0.05mol
故答案为:0.05.
点评:本题考查了化学平衡常数的计算,影响化学平衡的因素分析应用判断,掌握基础是关键,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
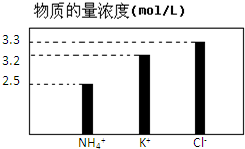 在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )| A、2、64、24 |
| B、16、50、24 |
| C、32、50、12 |
| D、64、2、24 |
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.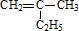 的键线式
的键线式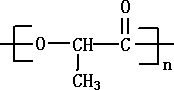 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为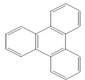 的一氯取代物有
的一氯取代物有
 分子中含氧官能团的名称是
分子中含氧官能团的名称是