题目内容
6.下列比较正确的是( )| A. | 元素的电负性:S>P | B. | 晶体的硬度:碳化硅<晶体硅 | ||
| C. | 酸性:H3PO4<H3PO3 | D. | 热分解温度:CaCO3>BaCO3 |
分析 A.同一周期元素从左到右电负性逐渐增大;
B.影响原子晶体硬度大小的因素是共价键的键长;
C.酸的电离常数越大,该酸的酸性越强;
D.晶格能越大,热分解温度越高,晶格能的主要影响因素是离子电荷,电荷越高,晶格能越大.其次就是离子半径,离子越小,晶格能越大.
解答 解:A.S、P属于同一周期,且原子序数逐渐增大,同一周期元素从左到右电负性逐渐增大,因此电负性S>P,故A正确;
B.原子半径Si>C,两者都为原子晶体,原子半径越大,共价键的键能越小,则硬度越小,所以晶体的硬度:碳化硅>晶体硅,故B错误;
C.H3PO4电离常数K1=7.1×10-3,H3PO3电离常数K1=3.7×10-2,H3PO4的电离常数大,酸性强,故C错误;
D.CaCO3、BaCO3离子电荷相同,Ca2+半径小于Ba2+半径,固体CaCO3晶格能大于BaCO3晶格能,所以热分解温度:CaCO3<BaCO3,故D错误;
故选A.
点评 本题考查电负性、晶体硬度、酸性强弱、离子晶体晶格能大小比较等知识,题目难度中等,注意D晶格能的主要影响因素是离子电荷,电荷越高,晶格能越大.其次就是离子半径,离子越小,晶格能越大,为高频考点、易错点.

练习册系列答案
相关题目
16.表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)画出原子结构示意图:⑪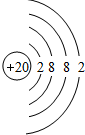 .
.
(5)用电子式表示⑦和⑩形成化合物的过程: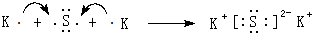 .
.
(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)画出原子结构示意图:⑪
 .
.(5)用电子式表示⑦和⑩形成化合物的过程:
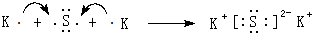 .
.(6)⑦和⑧分别形成的气态氢化物的化学式是H2S、HCl.其中相对不稳定的是H2S.
(7)在③与④中,化学性质较活泼的是Na(填元素符号),在⑧与⑫中,化学性质较活泼的是Cl,(填元素符号)如何证明(用离子方程式表示):Cl2+2Br-═Br2+2Cl-.
17.下列有关硅及其化合物的叙述中,错误的是( )
| A. | 单质硅是良好的半导体材料 | B. | 硅常温时可以和强碱反应 | ||
| C. | 二氧化硅广泛存在于自然界 | D. | 硅酸是挥发性酸 |
14.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A. | 原子半径Y>Z>X>W | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | a+3<c-2 |
1.下列关于晶体的说法中,不正确的是( )
①晶胞是晶体结构的基本单元
②分子晶体若是密堆积方式,其配位数都是12
③含有离子的晶体一定是离子晶体
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6.
①晶胞是晶体结构的基本单元
②分子晶体若是密堆积方式,其配位数都是12
③含有离子的晶体一定是离子晶体
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6.
| A. | ①③④⑦ | B. | ②④⑥⑧ | C. | ③⑤⑦⑧ | D. | ③④⑥⑦ |
11.下列说法正确的是( )
| A. | 海带中碘的提取实验中,将海带灰溶于水,过滤后在滤液中加入CCl4即可萃取 | |
| B. | 减压过滤可以过滤胶状沉淀或颗粒太小的沉淀 | |
| C. | 可通过观察硫代硫酸钠溶液和硫酸反应产生气体的快慢来比较化学反应速率的快慢 | |
| D. | 在“镀锌铁皮厚度测量”实验中,当锌在酸中完全溶解后,产生氢气的速率会显著减慢,可借此判断镀锌铁皮中锌镀层是否完全反应 |
18.下列有关实验说法正确的是( )
| A. | 在“阿司匹林的合成”实验中,把从盐酸中析出的晶体进行抽滤,用乙醇洗涤晶体1~2次,然后抽滤,将晶体转移到表面皿上,干燥后称其质量,计算产率 | |
| B. | 制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能溶液全部蒸干 | |
| C. | 晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液的浓度越高,或溶剂的蒸发速度越快,析出的晶粒就越细大 | |
| D. | 在“食醋总酸含量测定”实验中,将食醋稀释10倍后再滴定是为了减少食醋的浪费 |
16.铜有两种常见的氧化物CuO和Cu2O.某学习小组取0.98g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示:另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示.则下列分析正确的是( )


| A. | 图1中,A到B的过程中有0.005mol电子发生了转移 | |
| B. | 图1整个过程中共生成0.18g水 | |
| C. | 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A | |
| D. | 图1中A和B化学式分别为Cu2O和CuO |