题目内容
14.已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )| A. | 原子半径Y>Z>X>W | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | a+3<c-2 |
分析 1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.
解答 解:1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,
A.Y为O元素,Z为F元素,处于第二周期,W为Al元素,X为Na元素,处于第三周期,核电荷数越大半径越小,所以原子半径X>W>Y>Z,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HZ>H2Y,故B错误;
C.金属性Na>Al,金属性越强,阳离子氧化性越弱,故氧化性Al3+>Na+,故C正确;
D.根据电子排布相同可知,a-3=b-1=c+2=d+1,则a+3>c-2,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,明确离子电子层结构相同离子在周期表中的位置、原子序数大小顺序是解本题关键,熟练掌握元素周期律、原子结构并灵活运用知识解答问题,题目难度不大.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
4.下列有关功能高分子材料的用途的叙述中不正确的是( )
| A. | 高吸水性树脂可用于干旱地区抗旱保水、改良土壤、改造沙漠 | |
| B. | 离子交换树脂主要用于分离和提纯物质 | |
| C. | 医用高分子可用于制造医用器械和人造器官 | |
| D. | 聚乙炔膜可用于分离工业废水和海水的淡化 |
5.有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )


| A. | 电子由Al沿导线流向Cu | |
| B. | 电流由Cu电极流出 | |
| C. | Cu是原电池的负极 | |
| D. | 铝片上的电极反应式为:Al-3e-═Al3+ |
2.下列各物质中,化学键类型不同的是( )
| A. | H2O、CO | B. | MgF2、H2O2 | C. | KOH、Mg(OH)2 | D. | HCl、H2SO4 |
9.一定温度下,对反应2A(g)+B(s)?2C(g)能说明其达到平衡状态的是( )
| A. | 容积中A、B、C三者共存 | |
| B. | 单位时间内反应的A与生成的C的物质的量之比为1:1 | |
| C. | c(A):c(B):c(C)=2:1:2 | |
| D. | 气体的总质量不再发生变化 |
19.下列说法正确的是( )
| A. | 离子化合物NH4Cl中既存在离子键,又存在极性共价键 | |
| B. | H2S的电子式是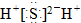 | |
| C. | 化学键包括离子键、共价键、氢键等 | |
| D. | LiOH、NaOH、KOH的碱性逐渐减弱 |
6.下列比较正确的是( )
| A. | 元素的电负性:S>P | B. | 晶体的硬度:碳化硅<晶体硅 | ||
| C. | 酸性:H3PO4<H3PO3 | D. | 热分解温度:CaCO3>BaCO3 |
3.下列有关电化学原理的说法中,错误的是( )
| A. | Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,铅为负极,PbO2为正极 | |
| B. | 电解氯化铜溶液,Cu2+向阴极迁移 | |
| C. | 氯碱工业中电解氯化钠溶液阴极产物为氯气 | |
| D. | 可充电的电池称“二次电池”,在充电时.是将电能转变成化学能,在放电时,又将化学能转化成电能 |
4.用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( )
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
| A. | ①②⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④ |