题目内容
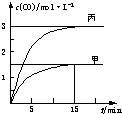 一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.
一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、1mol H2O | 1mol CO、1mol H2 | 4mol C、2mol H2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.01 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、由图可知,15min内甲容器中CO的浓度变化量为1.5mol/L,根据v=
计算v(CO),再利用速率之比等于化学计量数之比计算v(H2);
B、丙容器中起始量为甲的二倍,若容积=0.5 L,由于正反应为气体体积增大的反应,加压平衡左移,c(CO)<3mol/L;
C、根据甲容器中反应数据计算 T1℃时各物质的平衡浓度,再根据平衡常数K=
计算;
D、比较甲与乙可知,二者达等效平衡,根据甲、乙容器中平衡时n(H2O)的量可知,乙相对于甲平衡向逆反应移动,因为正反应吸热,乙中温度低,即温度T1>T2.
| △c |
| △t |
B、丙容器中起始量为甲的二倍,若容积=0.5 L,由于正反应为气体体积增大的反应,加压平衡左移,c(CO)<3mol/L;
C、根据甲容器中反应数据计算 T1℃时各物质的平衡浓度,再根据平衡常数K=
| c(CO)c(H2) |
| c(H2O) |
D、比较甲与乙可知,二者达等效平衡,根据甲、乙容器中平衡时n(H2O)的量可知,乙相对于甲平衡向逆反应移动,因为正反应吸热,乙中温度低,即温度T1>T2.
解答:
解:A、由图可知,15min内甲容器中CO的浓度变化量为1.5mol/L,v(CO)=
=0.1mol?L-1?min-1,速率之比等于化学计量数之比,所以v(H2)=0.1mol?L-1?min-1,故A错误;
B、丙容器中起始量为甲的二倍,若容积=0.5 L,由于正反应为气体体积增大的反应,加压平衡左移,c(CO)<3mol/L,故丙容器的体积V<0.5 L,故B正确;
C、根据甲容器中反应数据计算:
C(s)+H2O(g)═CO(g)+H2(g)
起始浓度(mol/L) 2 0 0
转化浓度(mol/L) 1.5 1.5 1.5
平衡浓度(mol/L) 0.5 1.5 1.5
T1℃时,反应的平衡常数K=
=
=4.5,故C错误;
D、比较甲与乙可知,二者达平衡是等效的,经计算知甲容器中平衡时n(H2O)=0.25 mol,乙容器中,若平衡时n(H2O)=0.4 mol,乙相对于甲平衡向逆反应移动,因为正反应吸热,乙中温度低,即温度T1>T2,故D错误;
故选B.
| 1.5mol/L |
| 15min |
B、丙容器中起始量为甲的二倍,若容积=0.5 L,由于正反应为气体体积增大的反应,加压平衡左移,c(CO)<3mol/L,故丙容器的体积V<0.5 L,故B正确;
C、根据甲容器中反应数据计算:
C(s)+H2O(g)═CO(g)+H2(g)
起始浓度(mol/L) 2 0 0
转化浓度(mol/L) 1.5 1.5 1.5
平衡浓度(mol/L) 0.5 1.5 1.5
T1℃时,反应的平衡常数K=
| c(CO)c(H2) |
| c(H2O) |
| 1.5×1.5 |
| 0.5 |
D、比较甲与乙可知,二者达平衡是等效的,经计算知甲容器中平衡时n(H2O)=0.25 mol,乙容器中,若平衡时n(H2O)=0.4 mol,乙相对于甲平衡向逆反应移动,因为正反应吸热,乙中温度低,即温度T1>T2,故D错误;
故选B.
点评:本题考查化学平衡移动、计算及化学平衡图象,难度中等,注意理解图象的纵坐标和横坐标的意义.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
五种短周期元素(用字母表示)在周期表中的相对位置如表,其中R原子中最外层电子数是最内层电子数的3倍.下列判断正确的是( )
| X | Y | ||
| Z | M | R |
| A、气态氢化物稳定性:X>Y |
| B、最高价氧化物的水化物的酸性:Y>M |
| C、Z单质是一种常用的半导体材料 |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |
下列各组中属于同位素关系的是( )
| A、16O和18O |
| B、T2O与H2O |
| C、24Mg和24Na |
| D、金刚石与石墨 |
下列除杂方法(括号内为杂质)操作正确的是( )
| A、乙醇(水) 加新制的生石灰,过滤 |
| B、乙烷(乙烯) 通过溴的四氯化碳溶液,洗气 |
| C、溴苯(苯) 加水,振荡静置后分液 |
| D、乙酸乙酯(乙酸) 加饱和NaHCO3溶液,振荡静置后分液 |
下列说法不正确的是( )
| A、某烷烃R的相对分子质量为86,1H核磁共振谱(1H-NMR)显示分子中有两个峰.则R的名称一定为2,3一二甲基丁烷 |
B、合成叶蝉散的反应属于加成反应 |
| C、有机物CH3(CH2)2CH(CH3)2的一氯代物有四种 |
| D、等质量的乳酸(C3H6O3)和葡萄糖分别完全燃烧,消耗氧气的物质的量相等 |
下列叙述正确的是( )


| A、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B、图一所示当有0.1mol电子转移时,有0.1mol Cu2O生成 |
| C、图二装置中发生:Cu+2Fe3+═Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D、如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |
用NA表示阿伏加德罗常数的值.下列判断错误的是( )
| A、NA个H+的质量为1 g |
| B、2 L 0.5 mol/L Na2SO4溶液中含2NA个Na+ |
| C、32 g O2中含有2NA个O原子 |
| D、标准状况下,22.4 L CCl4中含有NA个分子 |
下列说法不正确的是( )
| A、2011年诺贝尔化学奖授予以色列科学家达尼埃尔?谢赫特曼,以表彰他发现了准晶体.化学式为Al63Cu24Fe13的准晶体可与稀硝酸发生反应. |
| B、分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 |
| C、绿色化学的核心是应用化学原理对环境污染进行治理 |
| D、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A、Na+、H+、CO32-、Cl- |
| B、H+、Fe2+、Cl-、NO3- |
| C、Na+、Al3+、OH-、Cl- |
| D、NH4+、H+、OH-、NO3- |