题目内容
下列说法不正确的是( )
| A、某烷烃R的相对分子质量为86,1H核磁共振谱(1H-NMR)显示分子中有两个峰.则R的名称一定为2,3一二甲基丁烷 |
B、合成叶蝉散的反应属于加成反应 |
| C、有机物CH3(CH2)2CH(CH3)2的一氯代物有四种 |
| D、等质量的乳酸(C3H6O3)和葡萄糖分别完全燃烧,消耗氧气的物质的量相等 |
考点:有机化合物命名,同分异构现象和同分异构体,有机化学反应的综合应用
专题:有机化学基础
分析:A.1H核磁共振谱(1H-NMR)显示分子中有两个峰,说明该烷烃分子中含有两种位置不同的H,再根据烷烃的相对分子量确定其结构简式;
B.机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
C.有机物CH3(CH2)2CH(CH3)2中含有5种物质不同的氢原子,其一氯代物有5种;
D.乳酸(C3H6O3)和葡萄糖(C6H12O6)的最简式都是CH2O,所以等质量的二者消耗的氧气相同.
B.机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
C.有机物CH3(CH2)2CH(CH3)2中含有5种物质不同的氢原子,其一氯代物有5种;
D.乳酸(C3H6O3)和葡萄糖(C6H12O6)的最简式都是CH2O,所以等质量的二者消耗的氧气相同.
解答:
解:A.烷烃R的相对分子质量为86,则烷烃的分子式为C6H14,1H核磁共振谱(1H-NMR)显示分子中有两个峰,说明分子中只含有两种位置不同的氢原子,则该烷烃的名称为:2,3一二甲基丁烷,故A正确;
B.酚羟基和-NCO发生加成反应生成-OOCNH-,所以合成叶蝉散的反应属于加成反应,故B正确;
C.有机物CH3(CH2)2CH(CH3)2中含有5种位置不同的氢原子,所以其一氯代物有5种,故C错误;
D.等质量的乳酸(C3H6O3)和葡萄糖分别完全燃烧,由于乳酸(C3H6O3)和葡萄糖(C6H12O6)的最简式都是CH2O,则含有的各元素的质量相同,故消耗氧气的物质的量相等,故D正确;
故选C.
B.酚羟基和-NCO发生加成反应生成-OOCNH-,所以合成叶蝉散的反应属于加成反应,故B正确;
C.有机物CH3(CH2)2CH(CH3)2中含有5种位置不同的氢原子,所以其一氯代物有5种,故C错误;
D.等质量的乳酸(C3H6O3)和葡萄糖分别完全燃烧,由于乳酸(C3H6O3)和葡萄糖(C6H12O6)的最简式都是CH2O,则含有的各元素的质量相同,故消耗氧气的物质的量相等,故D正确;
故选C.
点评:本题考查了有机物结构简式书写、同分异构体求算、有机反应类型的判断,题目难度中等,注意掌握常见的有机物结构与性质,明确同分异构体的概念及求算方法,选项B为易错点,注意该反应的特点.

练习册系列答案
相关题目
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
| A、利用电池外壳的金属材料 |
| B、不使电池中泄漏的电解液腐蚀其他物品 |
| C、回收其中石墨电极 |
| D、防止电池中汞、镉和铅等重金属离子对水和土壤的污染 |
已知25℃,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是( )
| A、除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B、将足量CuSO4溶解在0.1mol?L-1 H2S溶液中,Cu2+的最大浓度为1.3×10-35mol?L-1 |
| C、因为H2SO4是强酸,所以反应CuSO4+H2S═CuS↓+H2SO4不能发生 |
| D、向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
氮化钠(Na3N)熔融时能导电,与水作用产生NH3.下列对氮化钠晶体描述错误的是( )
| A、构成晶体的两种微粒电子层结构相同 |
| B、构成晶体的两种微粒半径不相等 |
| C、与盐酸反应生成盐的化学键类型相同 |
| D、与盐酸反应生成盐的晶体类型相同 |
设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A、由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 |
| B、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| C、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
| D、2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数小于2NA |
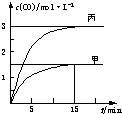 一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.
一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、1mol H2O | 1mol CO、1mol H2 | 4mol C、2mol H2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.01 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
某有机化合物的结构简式为 它可以发生的反应类型有( )
它可以发生的反应类型有( )
a取代 b加成 c消去 d酯化 e水解 f中和 g缩聚 h加聚.
 它可以发生的反应类型有( )
它可以发生的反应类型有( )a取代 b加成 c消去 d酯化 e水解 f中和 g缩聚 h加聚.
| A、acdf | B、befh |
| C、abcd | D、除eh外 |
NA为阿伏加德罗常数,下列说法中正确的是( )
| A、17gNH4+中含有的电子数为10NA |
| B、1mol?L-1Mg(NO3)2溶液中含有NO3-的数目为2NA |
| C、标准状况下,22.4L乙醇所含的分子数为NA |
| D、室温下,28.0g乙烯和丙烯中混合气体中含有的碳原子数为2NA |
下列有关有机物的叙述正确的是( )
| A、高聚物的相对分子质量一定为单体相对分子质量的整数倍 |
B、 分子中只存在羧基、羟基两种官能 分子中只存在羧基、羟基两种官能 |
C、PETG的结构简式为: 合成PETG的单体有4种 合成PETG的单体有4种 |
D、 分子中至少有16个原子共平面 分子中至少有16个原子共平面 |