题目内容
下列除杂方法(括号内为杂质)操作正确的是( )
| A、乙醇(水) 加新制的生石灰,过滤 |
| B、乙烷(乙烯) 通过溴的四氯化碳溶液,洗气 |
| C、溴苯(苯) 加水,振荡静置后分液 |
| D、乙酸乙酯(乙酸) 加饱和NaHCO3溶液,振荡静置后分液 |
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:A.应用蒸馏的方法除杂;
B.乙烯可与溴发生加成反应;
C.苯与溴苯混溶;
D.应用饱和碳酸钠溶液.
B.乙烯可与溴发生加成反应;
C.苯与溴苯混溶;
D.应用饱和碳酸钠溶液.
解答:
解:A.乙醇和水的沸点不同,应用蒸馏的方法除杂,故A错误;
B.乙烯可与溴发生加成反应,而乙烷不反应,故B正确;
C.苯与溴苯混溶,应用蒸馏的方法分离,故C错误;
D.应用饱和碳酸钠溶液,故D错误.
故选B.
B.乙烯可与溴发生加成反应,而乙烷不反应,故B正确;
C.苯与溴苯混溶,应用蒸馏的方法分离,故C错误;
D.应用饱和碳酸钠溶液,故D错误.
故选B.
点评:本题综合考查物质的分离提纯的实验设计,为高考常见题型和高频考点,侧重于化学知识的综合应用,题目难度中等,注意除杂时不能引入新的杂质.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列说法不正确的是( )
| A、“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
| B、蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质 |
| C、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 |
下列化学用语表达正确的是( )
| A、一氯乙烷的结构式CH3Cl |
| B、丁烷的结构简式CH3(CH2)2CH3 |
C、四氯化碳的电子式  |
D、C2H4分子比例模型: |
氮化钠(Na3N)熔融时能导电,与水作用产生NH3.下列对氮化钠晶体描述错误的是( )
| A、构成晶体的两种微粒电子层结构相同 |
| B、构成晶体的两种微粒半径不相等 |
| C、与盐酸反应生成盐的化学键类型相同 |
| D、与盐酸反应生成盐的晶体类型相同 |
常温下,下列溶液中可能大量共存的离子组是( )
| A、加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- |
| B、含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
| C、水电离产生的c(OH-)=1×10-10mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
| D、能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO32-、HCO3- |
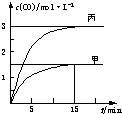 一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.
一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、1mol H2O | 1mol CO、1mol H2 | 4mol C、2mol H2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.01 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |
用图示装置(试剂任选)能完成下列实验的是( )


| A、从粗盐中获得NaCl晶体 |
| B、除去附着在铁屑表面的铝 |
| C、从含苯酚的废水中回收苯酚 |
| D、除去Fe(OH)3胶体中的FeCl3 |
不能说明X的非金属性比Y强的是( )
| A、X原子的最外层电子数比Y原子的最外层电子数多 |
| B、X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C、与H2化合时X单质比Y单质容易 |
| D、X单质可以把Y从其氢化物中置换出来 |