题目内容
五种短周期元素(用字母表示)在周期表中的相对位置如表,其中R原子中最外层电子数是最内层电子数的3倍.下列判断正确的是( )
| X | Y | ||
| Z | M | R |
| A、气态氢化物稳定性:X>Y |
| B、最高价氧化物的水化物的酸性:Y>M |
| C、Z单质是一种常用的半导体材料 |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:五种短周期元素,根据元素在周期表中的位置可知,X和Y属于第二周期元素,Z、M、R属于第三周期元素,R原子中最外层电子数是最内层电子数的3倍,则R最外层电子数是6,为S元素,则X是C、Y是N、Z是Al、M是P元素,再结合元素周期律解答.
解答:
解:五种短周期元素,根据元素在周期表中的位置知,X和Y属于第二周期元素,Z、M、R属于第三周期元素,R原子中最外层电子数是最内层电子数的3倍,则R最外层电子数是6,为S元素,则X是C、Y是N、Z是Al、M是P元素,
A.元素的非金属性越强,其氢化物越稳定,非金属性X<Y,则其氢化物的稳定性X<Y,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Y>M,则最高价氧化物的水化物的酸性:Y>M,故B正确;
C.Si是常用的一种半导体材料,Al是常用的导体,故C错误;
D.同一周期元素,其原子半径随着原子序数的增大而减小,所以Z、M、R的原子半径依次减小,故D错误;
故选B.
A.元素的非金属性越强,其氢化物越稳定,非金属性X<Y,则其氢化物的稳定性X<Y,故A错误;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Y>M,则最高价氧化物的水化物的酸性:Y>M,故B正确;
C.Si是常用的一种半导体材料,Al是常用的导体,故C错误;
D.同一周期元素,其原子半径随着原子序数的增大而减小,所以Z、M、R的原子半径依次减小,故D错误;
故选B.
点评:本题考查了元素周期表和元素周期律知识,根据元素在周期表中的位置确定元素,氢化物的稳定性、元素最高价氧化物的水化物酸性与非金属性的关系即可解答,及时总结归纳元素周期律知识,题目难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
| A、利用电池外壳的金属材料 |
| B、不使电池中泄漏的电解液腐蚀其他物品 |
| C、回收其中石墨电极 |
| D、防止电池中汞、镉和铅等重金属离子对水和土壤的污染 |
下列各组微粒具有相同的质子数和电子数的是( )
| A、OH-、H2O |
| B、NH4+、NH2- |
| C、H3O+、CH4 |
| D、HCl、F2 |
用VSEPR模型预测,下列分子形状与H2O相似,都为V型的是( )
| A、OF2 |
| B、BeCl2 |
| C、SO2 |
| D、CO2 |
下列说法不正确的是( )
| A、“地沟油”经加工处理后,可用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
| B、蔗糖、淀粉、油脂及其水解产物中既有电解质也有非电解质 |
| C、在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
| D、离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 |
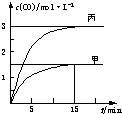 一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.
一定条件下存在反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示.| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2mol C、1mol H2O | 1mol CO、1mol H2 | 4mol C、2mol H2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.01 mol?L-1?min-1 |
| B、丙容器的体积V<0.5 L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |