题目内容
8.下列有关氯元素的说法中,正确的是( )| A. | 最高正化合价为+7 | B. | Cl2中含有极性共价键 | ||
| C. | HClO4比H2SO4酸性弱 | D. | Cl是卤素中原子半径最小的 |
分析 A、主族元素最高正价等于最外层电子数;
B、相同原子之间形成非极性共价键;
C、非金属性越强最高价氧化物对应水化物的酸性越强;
D、同主族从上往下原子半径逐渐减小.
解答 解:A、主族元素最高正价等于最外层电子数,所以最高正化合价为+7,故A正确;
B、相同原子之间形成非极性共价键,所以Cl2中含有非极性共价键,故B错误;
C、非金属性越强最高价氧化物对应水化物的酸性越强,非金属性氯强于硫,所以HClO4比H2SO4酸性强,故C错误;
D、同主族从上往下原子半径逐渐减小,所以F的原子半径最小,故D错误;
故选A.
点评 本题考查随着原子序数的递增,元素性质的变化,要理解元素性质呈周期性变化的原因是元素原子的核外电子排布的周期性变化的结果.

练习册系列答案
相关题目
19. 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | b点时,CO的转化率为20% | |
| B. | 容器内的压强保持恒定,表明反应达到平衡状态 | |
| C. | b点和d点的化学平衡常数:Kb>Kd | |
| D. | 0到0.5min反应速率V(CO)=0.3mol•L-1•min-1 |
3.现有A、B、C三种金属,把A浸入C的盐溶液中,A的表面有C析出;把A、B用导线连接后同时浸入稀硫酸中,电子流动方向为:B→导线→A.A、B、C三种金属的活动性顺序为( )
| A. | B>A>C | B. | A>C>B | C. | A>B>C | D. | B>C>A |
13.室温下,用0.1g金属粉末与10mL酸溶液反应,在反应开始阶段,产生H2的速率最快的是( )
| 金属(粉末状) | 酸的浓度 | |
| A | Mg | 6 mol/L硝酸 |
| B | Zn | 3 mol/L硫酸 |
| C | Fe | 6 mol/L盐酸 |
| D | Cu | 6 mol/L硫酸 |
| A. | A | B. | B | C. | C | D. | D |
17.某原电池装置示意图如图所示.下列关于该原电池的说法正确的是( )


| A. | 锌片发生还原反应 | |
| B. | 该装置将电能转化为化学能 | |
| C. | 电子由铁电极经导线流向锌电极 | |
| D. | 如果将锌片换成铜片,电路中的电流方向将会改变 |
18.下列离子方程式正确的是( )
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 大理石溶解于硝酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入足量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | Fe与稀HNO3反应:Fe+2H+═Fe2++H2↑ |

 .
. .
. 或
或 .
. 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下
的合成路线流程图(无机试剂任用).合成路线流程图示例如下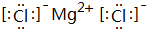 ,其中所含化学键的类型是离子键.
,其中所含化学键的类型是离子键.