题目内容
19. 利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)?5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入2molCO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | b点时,CO的转化率为20% | |
| B. | 容器内的压强保持恒定,表明反应达到平衡状态 | |
| C. | b点和d点的化学平衡常数:Kb>Kd | |
| D. | 0到0.5min反应速率V(CO)=0.3mol•L-1•min-1 |
分析 A、根据三行式来分析各物质的量,结合转化率等于$\frac{变化量}{起始量}×100%$;
B、两边计量数相等,所以压强始终不变;
C、b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd;
D、0到0.5min时CO2的体积分数(即物质量分数),列式计算即可求出从反应开始至a点时的反应速率为v(CO);
解答 解:A、5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol y y
b点量/mol 2-y y
根据a点时CO2的体积分数φ(CO2)=$\frac{y}{2}$=0.80,得y=1.6mol,转化率等于$\frac{变化量}{起始量}×100%$=$\frac{1.6}{2}$×100%=80%,故A错误;
B、两边计量数相等,所以压强始终不变,不能做平衡状态的标志,故B错误;
C、b点比d点时生成物CO2体积分数大,说明进行的程度大,则化学平衡常数:Kb>Kd,故C正确;
D、0到0.5min时:
5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 2 0
转化量/mol x x
a点量/mol 2-x x
根据a点时CO2的体积分数φ(CO2)=$\frac{x}{2}$=0.30,得x=0.6mol
则从反应开始至a点时的反应速率为v(CO)=$\frac{0.6mol}{2L×0.5min}$=0.6mol•L-1•min-1,故D错误;
故选C.
点评 本题题考查影响化学反应速率和化学平衡影响的因素,可以根据所学知识进行回答,难度不大.

 科学实验活动册系列答案
科学实验活动册系列答案| X | Y | W | Z | 反应体系能量变化 | |
| 甲 | 2mol | 1mol | 放出a kJ/mol | ||
| 乙 | 1mol | 1mol | 放出b kJ/mol | ||
| 丙 | 2mol | 2mol | 放出c kJ/mol | ||
| 丁 | 3mol | 2mol | 吸收d kJ/mol |
| A. | 平衡时丙容器中Z的物质的量浓度最大 | |
| B. | c+d<Q | |
| C. | 平衡时,甲容器中的反应速率比丁容器中的慢 | |
| D. | X的转化率为:甲<乙<丙 |
| A. | O2[PtF6]中只含离子键 | B. | O2[PtF6]中氧元素化合价为+1 | ||
| C. | 反应中O2是氧化剂,PtF6是还原剂 | D. | 每生成1molO2PtF6转移1mol电子 |
| A. | 60s时X的平均反应速率为0.02mol/L | |
| B. | 将容器容积变为20L,Z的新平衡浓度将等于原平衡浓度的$\frac{1}{2}$ | |
| C. | 若温度和体积不变,往容器内增加1molX,Y的转化率将增大 | |
| D. | 若升高温度,X的体积分数增大,则正反应的△H>0 |
| A. | 4种 | B. | 6种 | C. | 10种 | D. | 14种 |
| A. | 最高正化合价为+7 | B. | Cl2中含有极性共价键 | ||
| C. | HClO4比H2SO4酸性弱 | D. | Cl是卤素中原子半径最小的 |
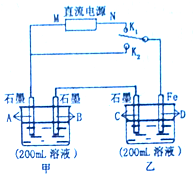 如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)
如图所示,甲、乙两个烧杯中的溶液中溶质离子分别由Na+、Cu2+、Cl-、SO42-四种离子中的一种阳离子和一种阴离子组成.(每种离子只能选用一次)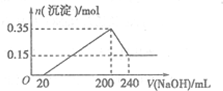 将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.
将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示.