题目内容
20.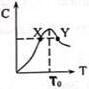 将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:(1)T0对应的反应速率V正和V逆的关系是=(填“>”“<”“=”表示,下同);
(2)X、Y两点A物质正反应速率的大小关系是Y>X;
(3)此反应的逆反应为放热热反应;温度T>T0时,C%逐渐减小的原因是T0到达平衡后,随着温度升高,平衡向吸热反应移动,即逆向移动,C的物质的量分数逐渐减小.
(4)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为1.8mol;若Y点时所耗时间为2min,则B物质的反应速率为0.06mol/(L.min).
分析 (1)起始时加入物质的量均为3.00mol的物质A、B,随着温度的升高,反应向正反应方向进行,当温度达到T0时,C的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等;
(2)温度越高,反应速率越大;
(3)到达平衡后,随着温度的继续升高,C的物质的量分数逐渐减小,说明温度升高平衡左移;
(4)设参加反应B为xmol,表示出2min各组分物质的量,再根据C的物质的量分数列方程计算,根据v=$\frac{△c}{△t}$计算v(B).
解答 解:(1)起始时加入物质的量均为3.00mol的物质A、B,随着温度的升高,反应向正反应方向进行,当温度达到T0时,C的物质的量分数最大,说明达到反应的最大限度,即平衡状态,此时正逆反应速率相等,故答案为:=;
(2)温度越高,反应速率越大,Y点温度大于X点,则X点反应速率小于Y点,
故答案为:Y>X;
(3)T0到达平衡后,随着温度继续升高,C的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,
故答案为:放;T0到达平衡后,随着温度升高,平衡向吸热反应移动,即逆向移动,C的物质的量分数逐渐减小;
(4)设参加反应的B的物质的量为x mol,则:
3A(g)+B(g)?2C(g)
起始量(mol):3 3 0
变化量(mol):3x x 2x
2min(mol):3-3x 3-x 2x
故$\frac{2x}{6-2x}$=25%,解得x=0.6,
故参加反应A的物质的量=3x mol=1.8mol,
v(B)=$\frac{\frac{0.6mol}{5L}}{2min}$=0.06mol/(L.min),
故答案为:1.8mol;0.06mol/(L.min).
点评 本题考查化学平衡计算、化学平衡图象、反应速率的计算等,难度中等,关键是理解曲线的变化原因.

| A. |  装置依据U管两边液面的高低判断Na和水反应的热效应 | |
| B. | 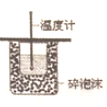 装置依据测定酸碱中和反应的中和热 | |
| C. | 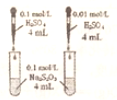 装置依据出现浑浊的先后顺序,比较浓度对反应速率的影响 | |
| D. | 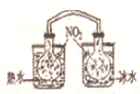 装置依据两容器内气体颜色变化,判断反应2NO${\;}_{{2}_{\;}}$(g)?N2O4(g)平衡移动的方向 |
| A. | 熔化状态下能导电的物质一定是离子化合物 | |
| B. | 单质分子中一定含有共价键 | |
| C. | 只由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键只存在极性键 |
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| B. | MgCO3与NaOH溶液反应生成沉淀:MgCO3+2OH-═Mg(OH)2↓+CO32- | |
| C. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 向NH4HSO4溶液中滴加过量NaOH溶液:NH4++HSO4-+2OH-═SO42-+NH3•H2O |
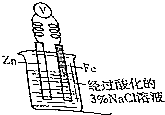 钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.