题目内容
9.下列说法中正确的是( )| A. | 熔化状态下能导电的物质一定是离子化合物 | |
| B. | 单质分子中一定含有共价键 | |
| C. | 只由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键只存在极性键 |
分析 A.熔融状态下能导电的物质可能是金属单质;
B.单质分子中可能不含化学键;
C.只由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物;
D.不同元素组成的多原子分子里的化学键存在极性键,也可能含有非极性键.
解答 解:A.熔融状态下能导电的物质可能是金属单质,如Cu等,故A错误;
B.单质分子中可能不含化学键,稀有气体中不含化学键,只含分子间作用力,故B错误;
C.只由非金属元素组成的化合物不一定是共价化合物,可能是离子化合物,如铵盐,故C正确;
D.不同元素组成的多原子分子里的化学键存在极性键,也可能含有非极性键,如多碳原子的烃等,故D错误;
故选C.
点评 本题考查离子化合物、化学键的关系,为高频考点,明确物质中存在的化学键及物质构成微粒是解本题关键,采用举例法分析解答,易错选项是B.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
17.降低大气中CO2的含量及有效地开发利用CO2,已引起了各国的普遍重视.工业上用CO、CO2来生产燃料甲醇、乙醇.
(1)图1表示CO(g)和H2(g)生成CH3OH(g)的反应过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂).写出该条件下该反应的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.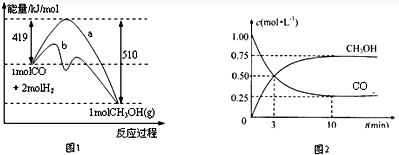
(2)为探究反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的原理,在体积为1L的密闭容器A中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L.min);CO2的转化率为75%.
②该温度下,反应达到平衡时,下列关系式正确的是a(填序号).
a.v正(CO2)=v逆(H2O(g)) b.$\frac{{P}_{起始}}{{P}_{平衡}}$=2 c.v正(H2)=v逆(CO2)d.$\frac{{P}_{起始}}{{P}_{平衡}}$=1.
③该温度下,反应的平衡常数=$\frac{16}{3}$.
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,在与A相同的条件下达到平衡,则两容器中H2的转化率:A容器<B容器(填“<”“>”或“=”).
(3)工业上以CO2和H2为原料合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),在一定压强下,测得的实验数据如下表:
①温度升高,该反应的平衡常数K值减小(填“增大”、“减小”或“不变”).
②表中X的取值范围是33<X<60.
(1)图1表示CO(g)和H2(g)生成CH3OH(g)的反应过程中能量的变化(曲线a未使用催化剂,曲线b使用催化剂).写出该条件下该反应的热化学方程式:CO(g)+2H2(g)=CH3OH(g)△H=-91 kJ/mol.

(2)为探究反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的原理,在体积为1L的密闭容器A中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol/(L.min);CO2的转化率为75%.
②该温度下,反应达到平衡时,下列关系式正确的是a(填序号).
a.v正(CO2)=v逆(H2O(g)) b.$\frac{{P}_{起始}}{{P}_{平衡}}$=2 c.v正(H2)=v逆(CO2)d.$\frac{{P}_{起始}}{{P}_{平衡}}$=1.
③该温度下,反应的平衡常数=$\frac{16}{3}$.
④若在体积1L的密闭容器B中,充入2molCO2和6molH2,在与A相同的条件下达到平衡,则两容器中H2的转化率:A容器<B容器(填“<”“>”或“=”).
(3)工业上以CO2和H2为原料合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),在一定压强下,测得的实验数据如下表:
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
②表中X的取值范围是33<X<60.
4.化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A. | “无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 | |
| B. | 无论是风力发电还是火力发电,都是将化学能转化为电能 | |
| C. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| D. | 硫的氧化物和氮的氧化物是形成酸雨的主要物质 |
14.下列金属冶炼的反应原理,不正确的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
1.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | A的生成速率与C分解的速率相等 | |
| B. | 单位时间生成nmolA,同时生成3nmolB | |
| C. | 单位时间生成nmolA,同时生成2nmolC | |
| D. | 单位时间生成B的速率与生成C的速率相等 |
18.下列离子方程式书写正确的是( )
| A. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Cl2通入水中 Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向浓盐酸中加二氧化锰:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑ |
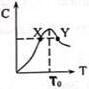 将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示: