题目内容
10. 钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.
钢铁是用量最大、用途最广的合金,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命.(1)抗腐蚀处理前,生产中常用盐酸除铁锈.现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生了多个化学反应,其中属于化合反应的化学方程式为:Fe2O3+6H+=2Fe3++3H2O;
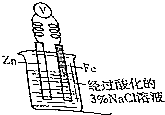
(2)如图所示是某同学验证“牺牲阳极的阴极保护法”的实验装置.已知:K3[Fe(CN)6](铁氰化钾)溶液遇Fe2+会变成特征的蓝色:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.
①在Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,观察到仍呈黄色,Fe电极发生的电极反应式为2H++2e-=H2↑;
②如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,Fe电极发生的电极反应式为Fe-2e-=Fe2+.
分析 (1)铁锈的成分为Fe2O3,能和酸反应生成盐和水;
(2)①锌比铁活泼,所以锌是负极,铁是正极;
②将锌改为Pt,则金属铁是负极,发生电极反应:Fe-2e-=Fe2+;滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,产生蓝色沉淀.
解答 解:(1)铁锈的成分为Fe2O3,能和酸反应生成盐和水,;离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)①锌易失电子作负极,铁作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,所以在Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,观察到仍呈黄色,Fe电极发生的电极反应式为:2H++2e-=H2↑,故答案为:仍呈黄色;2H++2e-=H2↑;
②将锌改为Pt,则金属铁是负极,发生电极反应:Fe-2e-=Fe2+;滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,产生蓝色沉淀,故答案为:产生蓝色沉淀;Fe-2e-=Fe2+.
点评 本题考查了原电池原理、离子的检验、配合物等知识点,明确原电池原理、亚铁离子的特点、配合物中配离子和配体的判断即可解答,有一定的难度.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
20.下列说法中,正确的是( )
| A. | 在任何条件下,纯水的pH都等于7 | |
| B. | 在任何条件下,纯水都呈中性 | |
| C. | 在95℃时,纯水的 pH小于7,显酸性 | |
| D. | 在95℃时,纯水中的[H+]小于10-7mol•L-1 |
1.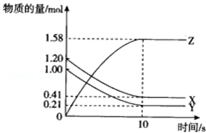 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
18.下列离子反应方程式中,属于水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | B. | NH3•H2O?NH4++OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
2.某气体可能含有NH3、HCl、CO、H2、CO2中的一种或几种,在恒温恒压下将其通过浓硫酸时,总体积基本不变;再通过足量的澄清石灰水,未见浑浊,但总体积减小;把剩余气体导出后点燃,燃烧产物不能使无水硫酸铜变蓝.则原气体中一定有( )
| A. | CO和HCl | B. | H2,HCl和CO | C. | CO2,CO和HCl | D. | CO2,CO |

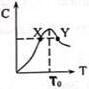 将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示: