题目内容
4.在一个容积为2L的密闭容器中加入2mol N2和6mol H2,发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,测得c(NH3)=0.5mol•L-1.(1)该条件下此反应的化学平衡常数的表达式K=$\frac{{{c^2}(N{H_3})}}{{c({N_2})•{c^3}({H_2})}}$.
(2)从反应开始到平衡,用H2的浓度变化表示的反应速率为0.15mol•L-1•min-1.
(3)若平衡时,移走1mol N2和3mol H2,在相同温度下再次达到平衡时c(NH3)<0.25mol•L-1 (填“>”、“<”或“=”).
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)5min时达到平衡,测得c(NH3)=0.5mol•L-1,可知v(NH3)=$\frac{0.5mol/L}{5min}$=0.1mol•L-1•min-1,结合速率之比等于化学计量数之比计算v(H2);
(3)移走1mol N2和3mol H2,若平衡不移动时c(NH3)=0.25mol•L-1,但n减小,p减小,平衡逆向移动.
解答 解:(1)K为生成物浓度幂之积与反应物浓度幂之积的比,则该条件下此反应的化学平衡常数的表达式K=$\frac{{{c^2}(N{H_3})}}{{c({N_2})•{c^3}({H_2})}}$,
故答案为:$\frac{{{c^2}(N{H_3})}}{{c({N_2})•{c^3}({H_2})}}$;
(2)5min时达到平衡,测得c(NH3)=0.5mol•L-1,可知v(NH3)=$\frac{0.5mol/L}{5min}$=0.1mol•L-1•min-1,由速率之比等于化学计量数之比可知v(H2)=0.1mol•L-1•min-1×$\frac{3}{2}$=0.15 mol•L-1•min-1,故答案为:0.15 mol•L-1•min-1;
(3)移走1mol N2和3mol H2,若平衡不移动时c(NH3)=0.25mol•L-1,但n减小,p减小,平衡逆向移动,则在相同温度下再次达到平衡时c(NH3)<0.25mol•L-1,故答案为:<.
点评 本题考查化学平衡的计算,为高频考点,把握K的意义、速率计算、平衡移动为解答的关键,侧重分析与计算能力的考查,注意(3)为解答的难点,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
9.对于可逆反应2SO2(g)+O2(g)?2SO3(g);△H<0,在一恒容容器中,由SO2和O2开始反应,下列说法正确的是( )
| A. | 充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快 | |
| B. | 反应进行的净速率是正、逆反应速率之差 | |
| C. | O2的消耗速率与SO3的生成速率之比为2:1 | |
| D. | 加入SO2,可使单位体积内活化分子百分比增多,加快反应速率 |
16.在一定温度下,NO2和CO在催化剂作用下发生反应4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,当反应达到平衡时,下列措施:①降温 ②恒容通入惰性气体 ③增加NO2浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高CO转化率的是( )
| A. | ①③④ | B. | ①④⑥ | C. | ②③⑤ | D. | ③⑤⑥ |
13.下列实验操作正确的是( )
| A. | 在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 | |
| B. | 实验室制用乙醇与浓硫酸制乙烯时,迅速升温到140℃ | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚,用水洗涤 | |
| D. | 取加热至亮棕色的纤维素水解液少许,滴入新制的氢氧化铜悬浊液加热,证明水解产物为葡萄糖 |
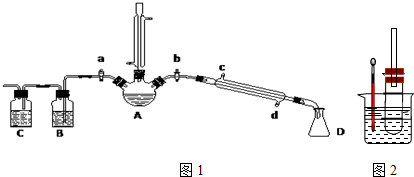
 .
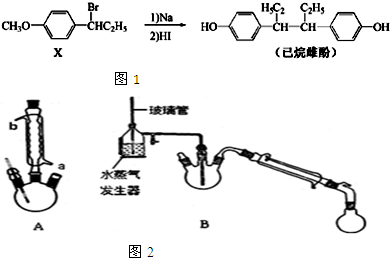
.

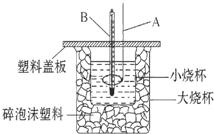 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.