题目内容
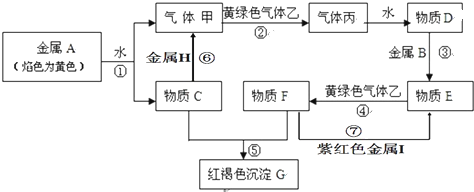
18.用黄铜矿进行铜的冶炼,冶炼过程大致可分为四个步骤:①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
④电解精炼铜.
下列说法正确的是( )
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
分析 A.根据最终产物为Cu、SO2和FeO可写出反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,根据总反应方程式判断;
B.尾气为SO2气体,可用来制取硫酸;
C.氧化还原反应中,元素化合价降低的反应物作氧化剂;
D.电解精炼铜的过程中,阳极溶解的不一定都是铜.
解答 解:A.用黄铜矿进行铜的冶炼,最终产物为Cu、SO2和FeO,所以反应的总分应方程式为6CuFeS2+15O2=6Cu+12SO2+6FeO,由1molCuFeS2制取1molCu时,共消耗2.5molO2,故A错误;
B.在铜的冶炼过程中,②焙烧、③制粗铜过程中都有二氧化硫生成,二氧化硫的制取硫酸的原料,所以冶炼过程中的尾气可用来制硫酸,故B正确;
C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,Cu的化合价由+1价升高为+2价,S的化合价由-2价升高为+4价,反应物中Cu2O只做氧化剂,Cu2S既是氧化剂又是还原剂,故C错误;
D.电解精炼铜的过程中,阳极溶解的不都是铜,比铜活泼的金属也会溶解,所以每转移1mol电子时,阳极溶解铜的质量不是32g,故D错误.
故选B.
点评 本题考查金属的冶炼以及氧化还原有关知识,题目难度不大,注意分析C项中各元素的化合价的变化特点,以正确分析氧化剂和还原剂.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.某学生用下列方法解决生活中的问题,不能获得成功的是( )
| A. | 用食醋和石灰水验证鸡蛋壳中含有碳酸钙 | |
| B. | 将淀粉在唾液淀粉酶的作用下水解 | |
| C. | 用米汤检验食盐中是否加了碘 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
9.(NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用化学试剂、医药以及用于冶金、电镀等.回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置在空气中也会变质,检验莫尔盐是否变质的试剂是KSCN溶液.
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如表:
①K2Cr2O7溶液应该放在酸式滴定管中.
②写出滴定过程中反应的离子方程式6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
③所测K2Cr2O7溶液的物质的量浓度为$\frac{m}{47.04}$mol/L(用含m的代数式表示).
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物.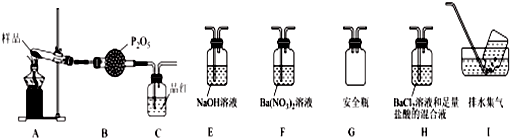
①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO2、H2O四种物质.你是否同意并说明理由:不同意,N、Fe的化合价均升高,没有化合价降低的元素.
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液(写一种即可).
③丙同学想利用上述装置证明分解产物中含有氨气,只需更换B、C中的试剂即可,则更换后的试剂为B碱石灰,C酚酞溶液.
④丁同学认为莫尔盐分解可能会生成N2、SO2,拟从下列装置中选择必要的装置加以证明,则正确的连接顺序从左到右依次是A、G、H、I.
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置在空气中也会变质,检验莫尔盐是否变质的试剂是KSCN溶液.
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如表:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
②写出滴定过程中反应的离子方程式6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
③所测K2Cr2O7溶液的物质的量浓度为$\frac{m}{47.04}$mol/L(用含m的代数式表示).
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物.

①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO2、H2O四种物质.你是否同意并说明理由:不同意,N、Fe的化合价均升高,没有化合价降低的元素.
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液(写一种即可).
③丙同学想利用上述装置证明分解产物中含有氨气,只需更换B、C中的试剂即可,则更换后的试剂为B碱石灰,C酚酞溶液.
④丁同学认为莫尔盐分解可能会生成N2、SO2,拟从下列装置中选择必要的装置加以证明,则正确的连接顺序从左到右依次是A、G、H、I.
6.下列关于可逆反应是否达到平衡状态的说法中不正确的是( )
| A. | 对于反应2AB(g)?A2(g)+B2(g),当容器中AB与A2的体积比不随时间变化,说明反应一定达到平衡状态 | |
| B. | 对于反应N2(g)+3H2(g)?2NH3(g),当1个N≡N键断裂的同时3个H-H键形成,说明反应一定达到平衡状态 | |
| C. | 在恒温,恒容密闭容器中如下反应:2HI(g)?H2(g)+I2(g)混合气体颜色不在变化,说明反应一定达到平衡 | |
| D. | 在恒温,恒容密闭容器中如下反应:X2(g)+Y2(g)?2Z(g)+W(s),当混合气体的平均相对分子质量或压强不随时间的变化而变化,说明反应一定达到平衡 |
13.根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3] | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | c(ClO-)>c(HCO3-)>c(OH-) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(ClO-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)+2c(CO32-) |
7.下列事实中,不能说明HR是弱酸的是( )
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |