题目内容
3.写出下列有机物的结构简式.(1)2、2-二甲基丁烷CH3C(CH3)2CH2CH3;
(2)3、4、4-三甲基-1-戊烯CH2=CHCH(CH3)C(CH3)2CH3;
(3)3、4-二甲基-3-乙基-已烷CH3CH2C(C2H5)(CH3)CH(CH3)CH2CH3;
(4)2,6-二甲基-4-乙基辛烷CH3CH(CH3)CH2CH(C2H5)CH2CH(CH3)CH2CH3;
(5)2-氯-丙烷CH3CH(Cl)CH3.
分析 (1)2、2-二甲基丁烷:该有机物为烷烃,最长碳链含有4个C,两个甲基在2号C,据此写出该有机物的结构简式;
(2)含有C=C双键的碳链有5个碳原子,双键处于端位置,从C=C双键一端编号,甲基处于3、4、4号碳原子上;
(3)3、4-二甲基-3-乙基-已烷,其主链为己烷,最长碳链含有6个C,在3、4号C各含有1个甲基,在3号C含有1个乙基;
(4)2,6-二甲基-4-乙基辛烷,其主链为辛烷,最长碳链含有8个C,在2、6号C各含有1个甲基,在4号C含有1个乙基;
(5)2-氯-丙烷,其主链为丙烷,最长碳链含有3个C,在2号C含有1个氯原子.
解答 解:(1)2、2-二甲基丁烷:主链为丁烷,在2号C含有2个甲基,该有机物的结构简式为:CH3C(CH3)2CH2CH3,
故答案为:CH3C(CH3)2CH2CH3;
(2)依据系统命名方法,结合名称写出结构简式3,4,4-三甲基-1-戊烯的结构简式为:CH2=CHCH(CH3)C(CH3)2CH3,
故答案为:CH2=CHCH(CH3)C(CH3)2CH3;
(3)3、4-二甲基-3-乙基-已烷,其主链为己烷,最长碳链含有6个C,在3、4号C各含有1个甲基,在3号C含有1个乙基,该有机物的结构简式为:CH3CH2C(C2H5)(CH3)CH(CH3)CH2CH3,
故答案为:CH3CH2C(C2H5)(CH3)CH(CH3)CH2CH3;
(4)2,6-二甲基-4-乙基辛烷,其主链为辛烷,最长碳链含有8个C,在2、6号C各含有1个甲基,在4号C含有1个乙基,该有机物的结构简式为:CH3CH(CH3)CH2CH(C2H5)CH2CH(CH3)CH2CH3,
故答案为:CH3CH(CH3)CH2CH(C2H5)CH2CH(CH3)CH2CH3;
(5)2-氯-丙烷,其主链为丙烷,最长碳链含有3个C,在2号C含有1个氯原子,该有机物的结构简式为:CH3CH(Cl)CH3,
故答案为:CH3CH(Cl)CH3.
点评 本题考查了有机物的命名、结构简式的书写,题目难度不大,试题侧重了基础知识的考查,注意掌握常见有机物的命名原则,能够根据名称书写有机物的结构简式.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 乙酸的结构简式:C2H4O2 | B. | Cl-的结构示意图为 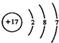 | ||
| C. | 中子数为20 的氯原子:3717Cl | D. | NH3 的电子式: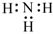 |
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

回答下列问题:
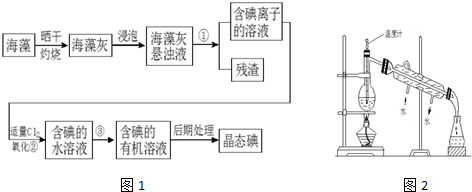
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4?CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分,其原因是因为CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4.
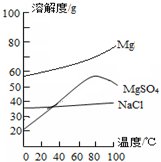
(3)已知一些盐的溶解度如图2.在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在80℃.
(4)步骤II操作是冷却结晶、洗涤,
(5)步骤III在工业上常用的设备是D(填字母).
A.加压干燥器B.蒸馏塔C.离心机D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4•7H2O的质量分数是$\frac{12.3({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{a}$%.
| A. | 平衡常数的大小只与温度有关,而与浓度、压强、催化剂等无关 | |
| B. | 在任何条件下,化学平衡常数都是一个定值 | |
| C. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度 | |
| D. | 从平衡常数大小可以推断一个反应进行的快慢 |
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
④电解精炼铜.
下列说法正确的是( )
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
| A. | 加入KSCN溶液,出现红色,一定不含Fe2+ | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| D. | 玻璃、水泥、陶瓷、刚玉都是硅酸盐材料 |
| A. | 乙烯的实验式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式  | D. | 臭氧的分子式O3 |
[实验设计]控制
p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成如表实验设计表(表中不要留空格).
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
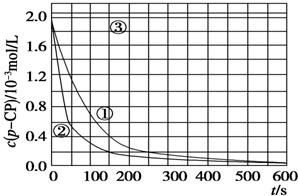 [数据处理]
[数据处理]实验测得p-CP的浓度随时间变化的关系如图.
(2)请根据如图实验①曲线,计算降解反应在50~150s内的反应速率:v(p-CP)=8.0×10-6mol/(L•s).
[解释与结论]
(3)实验①②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:过氧化氢在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.