题目内容
13.根据表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3] | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | c(ClO-)>c(HCO3-)>c(OH-) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(ClO-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)+2c(CO32-) |
分析 A.由表中数据可知酸性:H2CO3>HClO>HCO3-,以此判断盐类水解的程度及混合液中各离子浓度;
B.根据物料守恒c(HClO)+c(ClO-)=c(HCO3- )+c(H2CO3)+c(CO32-)=c(Na+)分析;
C.根据物料守恒判断,漏掉了碳酸根离子;
D.根据混合液中电荷守恒判断,阴离子漏掉了碳酸根离子.
解答 解:A.由表中数据可知,H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,则c(HCO3- )>c(ClO-),在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系为:c(HCO3-)>c(ClO-)>c(OH-),故A错误;
B.根据混合液中物料守恒可知:c(HClO)+c(ClO-)=c(HCO3- )+c(H2CO3)+c(CO32-)=c(Na+),则2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO),故B错误;
C.由物料守恒可知,等浓度的NaClO、NaHCO3混合溶液中,c(HClO)+c(ClO-)=c(HCO3- )+c(H2CO3)+c(CO32-)=c(Na+),故C错误;
D.由电荷守恒可知,溶液中一定满足:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D正确;
故选D.
点评 本题考查离子浓度的大小比较、盐的水解原理,题目难度中等,注意把握弱电解质的电离和盐类水解的原理,结合电荷守恒和物料守恒解答该类题目.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
13.下列有关甲烷分子结构的说法中,错误的是( )
| A. | 甲烷分子中含有4个C-H共价键 | |
| B. | 甲烷分子中C-H共价键的夹角为109°28' | |
| C. | 甲烷是正四面体结构 | |
| D. | 甲烷是一种直线型分子 |
4. 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.
(1)某新型储氢合金(化学式为Mg17Al12)的储氧原理为Mg17Al12+17H2=17MgH2+12Al,此变化中氧化产物是MgH2(填化学式).
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),请写出它与足量NaOH溶液混合时反应的化学方程式:H2C2O4+2NaOH=Na2C2O4+2H2O.
(3)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
则CH4(g)+H2O(g)?CO(g)+3H2(g)的△H=30.6KJ/mol.
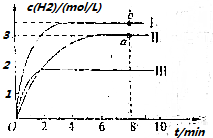
(4)向容积为2L的某恒容密闭容器中充入3molCH4、4molH2O,测出温度为T℃时,容器内H2物质的量浓度(mol/L)随时间的变化如图Ⅱ所示,图中Ⅰ、Ⅲ分别表示相对于Ⅱ仅改变反应条件后,c(H2)随时间的变化
①若曲线Ⅰ代表的是仅变化一种条件后的情况,则改变的条件可能是升温,a、b两点后用CO浓度变化表示的反应速率关系为a<b(填“>”“<”“=”).
②曲线Ⅱ对应反应的平衡常数为54,该温度下,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,则开始时H2的生成速率无法确定(填“>”“<”“=”或“无法确定”)H2的消耗速率.
③曲线Ⅲ相对于曲线Ⅱ改变的条件是b(填序号).
a.降低温度 b.使用催化剂、降低温度 c.充入氦气.
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.(1)某新型储氢合金(化学式为Mg17Al12)的储氧原理为Mg17Al12+17H2=17MgH2+12Al,此变化中氧化产物是MgH2(填化学式).
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),请写出它与足量NaOH溶液混合时反应的化学方程式:H2C2O4+2NaOH=Na2C2O4+2H2O.
(3)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
(4)向容积为2L的某恒容密闭容器中充入3molCH4、4molH2O,测出温度为T℃时,容器内H2物质的量浓度(mol/L)随时间的变化如图Ⅱ所示,图中Ⅰ、Ⅲ分别表示相对于Ⅱ仅改变反应条件后,c(H2)随时间的变化
①若曲线Ⅰ代表的是仅变化一种条件后的情况,则改变的条件可能是升温,a、b两点后用CO浓度变化表示的反应速率关系为a<b(填“>”“<”“=”).
②曲线Ⅱ对应反应的平衡常数为54,该温度下,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,则开始时H2的生成速率无法确定(填“>”“<”“=”或“无法确定”)H2的消耗速率.
③曲线Ⅲ相对于曲线Ⅱ改变的条件是b(填序号).
a.降低温度 b.使用催化剂、降低温度 c.充入氦气.
1.下列各组物质中,全部属于纯净物的是( )
| A. | 福尔马林、白酒、食醋 | B. | 冰醋酸、氯仿、乙醇钠 | ||
| C. | 无水酒精、甲苯、焦炉气 | D. | 乙烯、乙酸乙酯、煤 |
18.用黄铜矿进行铜的冶炼,冶炼过程大致可分为四个步骤:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
④电解精炼铜.
下列说法正确的是( )
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
④电解精炼铜.
下列说法正确的是( )
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
5.分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )


| A. | 分子中含有3种官能团 | |
| B. | 可与乙醇、乙酸、溴水发生反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与2molNaHCO3发生反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
2.除去下列括号内杂质的试剂或方法错误的是( )
| A. | C2H5OH(CH3COOH),加足量CaO,蒸馏 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 |
3.X、Y、Z、W均为短周期元素,原子序数依次增大.Y原子的M电子层有1个电子,同周期的简单离子的半径中Z最小.W与X同主族,其最高化合价是最低负化合价绝对值的3倍.下列说法正确的是( )
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单离子的半径:Y<X | D. | X分别与Z、W形成化合物的熔点:Z<W |