题目内容
9.(NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用化学试剂、医药以及用于冶金、电镀等.回答下列问题:(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置在空气中也会变质,检验莫尔盐是否变质的试剂是KSCN溶液.
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点.重复进行3次,测得有关数据如表:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.42 |
| Ⅲ | 0.00 | 19.92 |
②写出滴定过程中反应的离子方程式6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O.
③所测K2Cr2O7溶液的物质的量浓度为$\frac{m}{47.04}$mol/L(用含m的代数式表示).
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物.
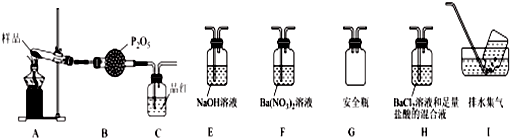
①甲同学提出猜想:分解产物可能是N2、Fe2O3、SO2、H2O四种物质.你是否同意并说明理由:不同意,N、Fe的化合价均升高,没有化合价降低的元素.
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有Fe2O3;C装置中红色褪去,说明气体产物中含有SO2;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是NaOH溶液(写一种即可).
③丙同学想利用上述装置证明分解产物中含有氨气,只需更换B、C中的试剂即可,则更换后的试剂为B碱石灰,C酚酞溶液.
④丁同学认为莫尔盐分解可能会生成N2、SO2,拟从下列装置中选择必要的装置加以证明,则正确的连接顺序从左到右依次是A、G、H、I.
分析 (1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质是盐中亚铁离子被氧化为铁离子,依据铁离子的检验方法选择试剂检验莫尔盐是否变质;
(2)①K2Cr2O7溶液中溶质为强氧化剂,能氧化橡胶管;
②酸性溶液中亚铁离子被重铬酸钾氧化为铁离子,重铬酸钾被还原为铬离子,结合原子守恒和电荷守恒配平书写离子方程式;
③图表数据中Ⅱ数据误差较大舍去,计算平均消耗溶液体积,结合离子方程式定量关系计算得到溶液浓度;
(3)①摩尔盐中N为-3价,Fe为+2价,S为+6价,根据产物中化合价分析;
②(NH4)2Fe(SO4)2•6H2O受热分解的固体为红色固体,依据盐中元素守恒分析判断,红色固体为氧化铁,品红溶液褪色是二氧化硫的特征性质,二氧化硫是酸性氧化物,二氧化硫有毒污染空气,需要尾气吸收,用氢氧化钠溶液吸收;
③验证固体分解生成的气体中生成氨气,用碱石灰干燥气体除去酸性氧化物气体,氨气溶于水反应生成的是一水合氨溶液,一水合氨电离出氢氧根离子溶液显碱性;
④莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明,利用装置A连接装置G安全瓶防止倒吸,通过装置H中的氯化钡溶液和盐酸混合溶液生成白色沉淀硫酸钡,证明生成三氧化硫.
解答 解:(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质是盐中亚铁离子被氧化为铁离子,检验莫尔盐是否变质的试剂是KSCN溶液,加入KSCN溶液后溶液变红色证明被氧化,若不变红色证明未被氧化,
故答案为:KSCN溶液;
(2)①K2Cr2O7溶液中溶质为强氧化剂,能氧化橡胶管,不能盛放在碱式滴定管中,应盛放在酸洗滴定管中,故答案为:酸;
②准确称取mg纯净的莫尔盐,在锥形瓶中加人20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点,酸性溶液中亚铁离子被重铬酸钾氧化为铁离子,重铬酸钾被还原为铬离子,反应的离子方程式为:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O,
故答案为:6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O;
③图表数据中Ⅱ数据误差较大舍去,计算平均消耗溶液体积V=$\frac{22.58-2.5+19.92}{2}$ml=20ml,设重铬酸钾溶液浓度为c,
6Fe2++14H++Cr2O72-=2Cr3++6Fe3++7H2O
6 1
$\frac{m}{392}$mol 0.020L×c
c=$\frac{m}{47.04}$mol/L,
故答案为:$\frac{m}{47.04}$;
(3)①N2、Fe2O3,SO3、H2O反应时有Fe元素的化合价升高,氮元素化合价升高,无元素化合价降低不符合氧化还原反应规律,
故答案为:不同意,N、Fe的化合价均升高,没有化合价降低的元素;
②(NH4)2Fe(SO4)2•6H2O受热分解的固体为红色固体,依据盐中元素守恒分析判断,红色固体只能为氧化铁,品红溶液褪色是二氧化硫的特征性质,C装置中红色褪去,说明气体产物中含有二氧化硫,二氧化硫是酸性氧化物,二氧化硫有毒污染空气,需要尾气吸收,用氢氧化钠溶液吸收,
故答案为:Fe2O3;SO2;NaOH溶液;
③利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B干燥管中用碱石灰吸收水蒸气、生成的二氧化硫或三氧化硫,C装置中是酚酞溶液,气体通入会变红色,证明生成的气体为氨气,
故答案为:碱石灰;酚酞溶液;
④要检验生成SO3(g)、N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、H、I;
故答案为:G、H、I.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度中等.

| A. | 0.5 mol | B. | 5 mol | C. | 196g | D. | 98g |
 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.(1)某新型储氢合金(化学式为Mg17Al12)的储氧原理为Mg17Al12+17H2=17MgH2+12Al,此变化中氧化产物是MgH2(填化学式).
(2)C2O3是一种无色无味的气体,可溶于水生成草酸(H2C2O4),请写出它与足量NaOH溶液混合时反应的化学方程式:H2C2O4+2NaOH=Na2C2O4+2H2O.
(3)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-198kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-846.3kJ•mol-1
| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
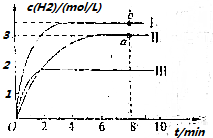
(4)向容积为2L的某恒容密闭容器中充入3molCH4、4molH2O,测出温度为T℃时,容器内H2物质的量浓度(mol/L)随时间的变化如图Ⅱ所示,图中Ⅰ、Ⅲ分别表示相对于Ⅱ仅改变反应条件后,c(H2)随时间的变化
①若曲线Ⅰ代表的是仅变化一种条件后的情况,则改变的条件可能是升温,a、b两点后用CO浓度变化表示的反应速率关系为a<b(填“>”“<”“=”).
②曲线Ⅱ对应反应的平衡常数为54,该温度下,若将等物质的量浓度的CH4、H2O、CO、H2混合在该容器中,则开始时H2的生成速率无法确定(填“>”“<”“=”或“无法确定”)H2的消耗速率.
③曲线Ⅲ相对于曲线Ⅱ改变的条件是b(填序号).
a.降低温度 b.使用催化剂、降低温度 c.充入氦气.
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | SiO2等不溶于酸的物质 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |

回答下列问题:
(1)反应器中加入酸溶解,反应液控制pH为5左右,反应温度在50℃左右,写出有关化学反应方程式Mg(OH)2+H2SO4═MgSO4+2H2O;CaCO3+H2SO4?CaSO4+H2O+CO2↑.
(2)在滤饼中检测到硫酸钙的成分,其原因是因为CaCO3+H2SO4?CaSO4+H2CO3,加热有H2CO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑,降低c(H2CO3),所以平衡不断向右移动,最终CaCO3生成了CaSO4.
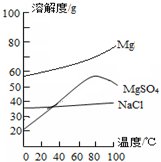
(3)已知一些盐的溶解度如图2.在滤液I中通入高温水蒸气进行蒸发结晶,为了析出晶体I,应控制温度在80℃.
(4)步骤II操作是冷却结晶、洗涤,
(5)步骤III在工业上常用的设备是D(填字母).
A.加压干燥器B.蒸馏塔C.离心机D.真空干燥器
(6)准确称取制备产品ag,将其加入到盛有V1mL c1mol/L的NaOH溶液的锥形瓶中,溶解后,加入酚酞溶液2滴,溶液变红色,再用c2mol/L的盐酸进行滴定,消耗盐酸V2mL,则样品MgSO4•7H2O的质量分数是$\frac{12.3({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{a}$%.
| A. | 福尔马林、白酒、食醋 | B. | 冰醋酸、氯仿、乙醇钠 | ||
| C. | 无水酒精、甲苯、焦炉气 | D. | 乙烯、乙酸乙酯、煤 |
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑
④电解精炼铜.
下列说法正确的是( )
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
| A. | HCl | B. | HF | C. | HI | D. | HBr |
