题目内容
13.某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是( )①原溶液中的I-一定全部被氧化;
②通入氯气之后原溶液中的Fe2+可能全部被氧化;
③不能确定通入氯气后的溶液中Br-是否被氧化;
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
分析 通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,可知亚铁离子被氧化,则由还原性I->Fe2+>Br-可知,则碘离子完全被氧化,溴离子可能被氧化,以此来解答.
解答 解:通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,可知亚铁离子被氧化,则由还原性I->Fe2+>Br-可知,则碘离子完全被氧化,溴离子可能被氧化,
①由上述分析可知,原溶液中的I-一定全部被氧化,故正确;
②生成铁离子,则通入氯气之后原溶液中的Fe2+可能全部被氧化,故正确;
③由上述分析可知,不能确定通入氯气后的溶液中Br-是否被氧化,故正确;
④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,白色沉淀为AgCl,说明原溶液中的I-、Fe2+、Br-均被完全氧化,故正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握还原性的强弱及氧化的先后顺序为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
4.下列关于电解质、非电解质的说法正确的是( )
| A. | 氯气溶于水得氯水,该溶液能导电,因此氯气是电解质 | |
| B. | CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质 | |
| C. | HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质 | |
| D. | 导电能力弱的溶液肯定是弱电解质的溶液 |
1.某一元醇A和一元羧酸B形成的酯的式量为212,分子内碳原子数是氢、氧原子数之和.该酯不能使溴的四氯化碳溶液褪色,又知A可氧化得B.则下列叙述中,正确的是( )
| A. | A的式量比B大14 | |
| B. | B的式量比A大16 | |
| C. | 该酯中一定不含双键等不饱和键 | |
| D. | 酯、A、B三种物质的分子中都含一种相同的式量大于45的原子团 |
8.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀盐酸与0.1 mol•L-1 KOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=+57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
18.实验室鉴别庚烷、1-庚烯和甲苯,所采用的试剂可以是下列中的( )
| A. | 溴水石蕊溶液 | B. | 氢氧化钠溶液和溴水 | ||
| C. | 溴水和高锰酸钾酸性溶液 | D. | 高锰酸钾溶液 |
2.镁铝合金质优体轻,又不易锈蚀,在大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金的性质的叙述中,正确的是( )
| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都大 |
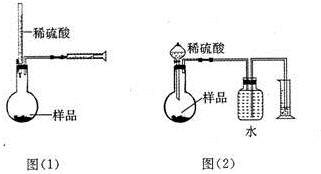 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.



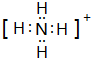 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.