题目内容
2.镁铝合金质优体轻,又不易锈蚀,在大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金的性质的叙述中,正确的是( )| A. | 此合金的熔点比镁和铝的熔点都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 此合金的硬度比镁和铝的硬度都大 |
分析 根据合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金的硬度比组成它的纯金属的硬度大,合金的熔点比组成它的纯金属的熔点低,结合金属的化学性质,进行分析判断.
解答 解:A.合金的熔点比各成分金属的低,故A错误;
B.此合金的主要成分是镁和铝,均能与稀盐酸反应,能全部溶解于稀盐酸中,故B正确;
C.此合金属于镁和铝的混合物,铝与氢氧化钠,故C错误;
D.合金的硬度比各成分金属的高,故D正确.
故选BD.
点评 本题考查金属与合金在性能上的主要差异,难度不大,主要考查合金的特征,掌握合金的特征、金属的化学性质是正确解答本题的关键.

练习册系列答案
相关题目
12.下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第8项的分子式应为C80H162.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | … |
| … | C2H6 | C5H12 | C8H18 | … | … | … | … |
17.以下有关物质的量浓度的叙述正确的是( )
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{4.0×74.5}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
7.使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图:
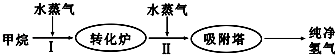
(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
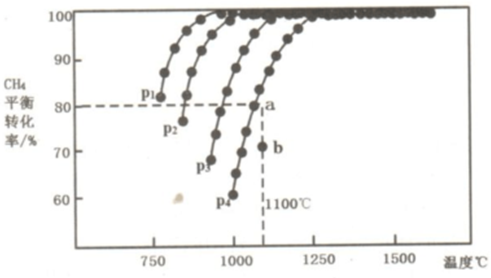
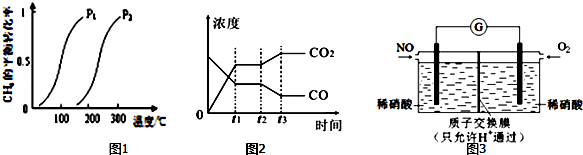
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
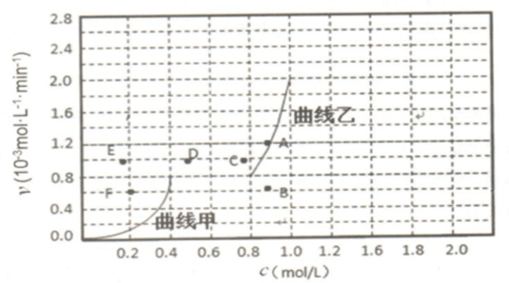
从上表可以推断:该反应是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为75%.图2表示该反应在t1时刻达到平衡、在t2时刻因改变某个条件引起浓度变化的情况:图2中t2时刻发生改变的条件是降低温度.增加水蒸汽的量或减少氢气的量(写出一种).
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

(1)工业上常利用反应Ⅰ产生的CO和H2合成可再生能源甲醇.
①已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ•mol-1和726.5kJ•mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-443.5kJ•mol-1.
此流程的第Ⅰ步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1<P2.(填“<”、“>”或“=”)100℃时,将1mol CH4和2mol H2O通入容积为10L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-2.
(3)此流程的第Ⅱ步反应CO(g)+H2O(g)?CO2(g)+H2(g),的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(4)某化学兴趣小组构想将NO转化为HNO3(NO3-),装置如图3,电极为多孔惰性材料.则负极的电极反应式是2H2O+NO-3e-=NO3-+4H+.

14.某密闭容器中,A(s)+3 B(g)?2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )
| A. | 加入少量A,B的转化率增大 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 增大压强,平衡不移动,正、逆反应速率不变 | |
| D. | 加入催化剂,反应速率增大,平衡常数不变 |