题目内容
5.有四种晶体,其离子排列方式下图所示,其中化学式不属AB型的是( )| A. |  | B. |  | C. |  | D. |  |
分析 顶点原子为8个晶胞共用、面心原子为2个晶胞共用,棱上原子为4个晶胞共用,体心原子为一个晶胞独有,利用均摊法计算晶胞中原子数目确定化学式.
解答 解:A.晶胞中A原子数目为8×$\frac{1}{8}$=1、B原子数目为1,化学式为AB,故A不选;
B.晶胞中A原子数目为4×$\frac{1}{8}$=$\frac{1}{2}$、B原子数目为4×$\frac{1}{8}$=$\frac{1}{2}$,化学式为AB,故B不选;
C.晶胞中A原子数目为8×$\frac{1}{8}$=1、B原子数目为12×$\frac{1}{4}$=3,化学式为AB3,故C选;
D.晶胞中A原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、B原子数目为1+12×$\frac{1}{4}$=4,化学式为AB,故D不选,
故选:C.
点评 本题考查晶胞计算,比较基础,注意利用均摊法进行晶胞有关计算,有利于基础知识的巩固.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
15.下列叙述中,正确的是( )
| A. | 在船舶的外壳装上铜块可防止其发生电化学腐蚀 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | MnO2、FeCl3和CuSO4都可加快H2O2的分解速率 | |
| D. | 用惰性电极分别电解CuCl2溶液和MgCl2溶液分别得到单质Cu和Mg |
16.在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( )
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、S2- |
20.下列关于元素周期表的说法正确的是( )
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 原子序数为14的元素位于元素周期表的第3周期ⅣA族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 最外层电子数是次外层电子数的2倍的原子容易失去电子成为阳离子 |
17.以下有关物质的量浓度的叙述正确的是( )
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1 mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-)相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174 g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为$\frac{4.0×74.5}{1.174×1000}$×100% | |
| D. | 20℃时,100 g水可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2% |
14.某密闭容器中,A(s)+3 B(g)?2 C(g)+D(g)△H>0在一定条件下达到平衡,下列说法正确的是( )
| A. | 加入少量A,B的转化率增大 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 增大压强,平衡不移动,正、逆反应速率不变 | |
| D. | 加入催化剂,反应速率增大,平衡常数不变 |
5.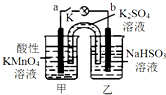 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 乙烧杯发生的反应:HSO3--2e-+H2O═SO42-+3H+ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 | |
| D. | 外电路的电子方向是从b到a |