题目内容
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)写出该反应的热化学方程式 .
(2)已知H2O(l)═H2O(g);△H=+44kJ?mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是 kJ.
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是 .
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ?mol-1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=-534kJ?mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 .
(5)已知:N2(g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-543kJ/mol
H2(g)+
F2 (g)=HF(g)△H=-269kJ/mol
H2(g)+
O2 (g)=H2O(g)△H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: .
(1)写出该反应的热化学方程式
(2)已知H2O(l)═H2O(g);△H=+44kJ?mol-1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(4)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ?mol-1,N2H4(g)+O2(g)═N2(g)+2H2O (g);△H=-534kJ?mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式
(5)已知:N2(g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-543kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
考点:热化学方程式,有关反应热的计算,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
(2)根据盖斯定律书写计算;
(3)根据燃烧产物无污染来分析;
(4)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式;
(5)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式;
(2)根据盖斯定律书写计算;
(3)根据燃烧产物无污染来分析;
(4)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式;
(5)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式;
解答:
解:(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
②H2O(l)═H2O(g)△H=+44kJ?mol-1,
依据盖斯定律①-②×4得到,N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ?mol-1;
16g液态肼物质的量为0.5mol,燃烧生成氮气和液态水时,放出的热量是:
817.625 kJ×0.5=408.8KJ;
故答案为:408.8;
(3)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气.;
故答案为:生成N2和H2O,对环境无污染;
(4)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(5)①N2(g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-543kJ/mol
③
H2(g)+
F2 (g)=HF(g)△H=-269kJ/mol
④H2(g)+
O2 (g)=H2O(g)△H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式,依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
②H2O(l)═H2O(g)△H=+44kJ?mol-1,
依据盖斯定律①-②×4得到,N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.625 kJ?mol-1;
16g液态肼物质的量为0.5mol,燃烧生成氮气和液态水时,放出的热量是:
817.625 kJ×0.5=408.8KJ;
故答案为:408.8;
(3)除释放大量热和快速产生大量气体外,生成物为氮气和水,不污染空气,故答案为:生成物为氮气和水,不污染空气.;
故答案为:生成N2和H2O,对环境无污染;
(4)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
(5)①N2(g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O (g)△H=-543kJ/mol
③
| 1 |
| 2 |
| 1 |
| 2 |
④H2(g)+
| 1 |
| 2 |
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式,依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ?mol-1;
点评:本题考查了热化学方程式的计算和盖斯定律的计算应用,理解实质,掌握基础是解题关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中属于含有共价键的离子化合物的是( )
| A、H2SO4 |
| B、KOH |
| C、CO2 |
| D、CaCl2 |
 甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电流正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙.(C1、C2、C3为石墨棒)则下列叙述正确的是( )
甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电流正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙.(C1、C2、C3为石墨棒)则下列叙述正确的是( )| A、甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B、C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C、C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D、甲、丙中溶液的pH值都逐渐升高 |
以NA表示阿伏加德罗常数,下列说法错误的是( )
| A、1mol P4中P-P键的数目为6NA |
| B、1mol Na2O2晶体中含有阴阳离子总数为4NA |
| C、30g SiO2晶体中含有Si-O键数目为2NA |
| D、6g金刚石中含有的碳碳键数目为1NA |
厨房中的化学知识很多,下面是有关厨房中的常见操作或现象,其中不属于氧化还原反应的是( )
| A、烧菜用过的铁锅,放置较长时间出现红棕色斑迹 |
| B、用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量 |
| C、牛奶久置变质腐败 |
| D、用食醋除去水瓶中的水垢 |
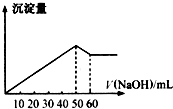 (1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
(1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为