题目内容
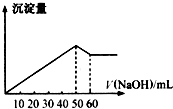 (1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
(1)在某Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为(2)一定量的Fe和Fe2O3混合物投入250ml 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成1.12L NO气体(标况),再向反应后溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
(3).某液体化合物X2Y4,常用做火箭燃料.16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)═X2(g)+2Y2O(l).冷却后标准状况下测得生成物的体积为11.2L,其密度为1.25g?L-1,则:①反应前O2的体积V(O2)为
②X2的摩尔质量为
③若反应生成0.5mol X2,则转移电子的物质的量为
考点:化学方程式的有关计算,氧化还原反应的电子转移数目计算,有关混合物反应的计算
专题:计算题
分析:(1)首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积,确定溶液中n(Mg2+):n(Al3+),据此计算解答;
(2)HNO3的物质的量为0.25L×2mol/L=0.5mol,生成NO的物质的量为:
=0.05mol,根据N元素质量守恒计算;
(3)①根据方程式中N2和氧气的关系式计算氧气的体积;
②根据摩尔质量M=Vm×ρ计算.X元素形成的单质是空气中含量最多的气体,则X是N元素,反应后的气体为N2,11.2LX2的物质的量=
=0.5mol,物质的相对分子质量在数值上等于其摩尔质量,根据Y的相对原子质量确定该元素名称;
③根据元素化合价确定转移电子的物质的量.
(2)HNO3的物质的量为0.25L×2mol/L=0.5mol,生成NO的物质的量为:
| 1.12L |
| 22.4L/moL |
(3)①根据方程式中N2和氧气的关系式计算氧气的体积;
②根据摩尔质量M=Vm×ρ计算.X元素形成的单质是空气中含量最多的气体,则X是N元素,反应后的气体为N2,11.2LX2的物质的量=
| 11.2L |
| 22.4L/mol |
③根据元素化合价确定转移电子的物质的量.
解答:
解:(1)首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液50mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积为50mL-30mL=20mL,则n(Mg2+):n(Al3+)=
×20mL:
×30mL=1:1,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为
:1=1:2,故答案为:1:2;
(2)解:HNO3的物质的量为0.025L×2mol/L=0.5mol,
生成NO的物质的量为:
=0.05mol,
所以与一定量Fe和Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为0.5mol-0.05mol=0.45mol,
再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,
所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.45mol,
则所加NaOH溶液的体积最少是
=0.45L,即450ml,故答案为:450ml;
(3)①该反应方程式知,N2和氧气的关系式为1:1,所以生成N2的体积等于氧气的体积为11.2L,
故答案为:11.2L;
②生成物只有X2为气体,M=Vm×ρ=22.4L/mol×1.25g/L=28g/mol,故答案为:28g/mol.X元素形成的单质是空气中含量最多的气体,则X是N元素,反应后的气体为N2,11.2LX2的物质的量=
=0.5mol,根据氮气和N2Y4的关系式知,反应N2Y4的物质的量为0.5mol,则M(N2Y4)=
=32g/mol,N元素的相对原子质量是14,所以Y的相对原子质量是1,为H元素,所以结构式为 ;
;
故答案为:28; ;
;
(3)该反应方程式中,O元素的化合价由0价变为价-2,所以若参加反应1mol O2,生成1mol的X2,则转移电子的物质的量4mol,则生成0.5mol X2,则转移电子的物质的量为2mol;故答案为:2mol.
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 2 |
(2)解:HNO3的物质的量为0.025L×2mol/L=0.5mol,
生成NO的物质的量为:
| 1.12L |
| 22.4L/moL |
所以与一定量Fe和Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为0.5mol-0.05mol=0.45mol,
再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所得溶液的溶质为NaNO3,
所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.45mol,
则所加NaOH溶液的体积最少是
| 0.45mol |
| 1mol/L |
(3)①该反应方程式知,N2和氧气的关系式为1:1,所以生成N2的体积等于氧气的体积为11.2L,
故答案为:11.2L;
②生成物只有X2为气体,M=Vm×ρ=22.4L/mol×1.25g/L=28g/mol,故答案为:28g/mol.X元素形成的单质是空气中含量最多的气体,则X是N元素,反应后的气体为N2,11.2LX2的物质的量=
| 11.2L |
| 22.4L/mol |
| 16g |
| 0.5mol |
 ;
;故答案为:28;
 ;
;(3)该反应方程式中,O元素的化合价由0价变为价-2,所以若参加反应1mol O2,生成1mol的X2,则转移电子的物质的量4mol,则生成0.5mol X2,则转移电子的物质的量为2mol;故答案为:2mol.
点评:本题考查了根据方程式进行物质的量的计算,明确反应方程式中各个物理量之间的关系是解本题关键,再结合基本公式来分析解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
现有下列三个反应:①2FeCl3+2KI=2FeCl2+2KCl+I2 ②2FeCl2+CL2=2FeCl3 ③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O 若FeCl2 溶液中含有I- 杂质,氧化除去I- 杂质可加入试剂( )
| A、Cl2 |
| B、盐酸 |
| C、KMnO4 |
| D、FeCl3 |
下列说法,你认为不正确的是( )
| A、平衡常数随温度的改变而改变 | ||||||
| B、对于密闭容器中反应2SO2+O2?2SO3,2体积SO2与足量O2反应,能生成2体积SO3 | ||||||
| C、合成氨反应中使用催化剂,降低了反应所需要的活化能 | ||||||
D、反应H2(g)+I2(g)?2HI(g) 在450℃时,其平衡常数为49;则反应HI(g)?
|
分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据,正确的是( )
| A、H2SO4是酸,因为H2SO4中含有氢元素 |
| B、氯化钠晶体不能导电,所以氯化钠不是电解质、 |
| C、2Na+2H2O═2NaOH+H2↑不是离子反应,因为反应中没有离子参加 |
| D、8NH3+3Cl2═N2+6NH4Cl是氧化还原反应,因为反应中存在电子的转移 |
 学习化学时可用如图表示某些从属关系,下列选项正确的是( )
学习化学时可用如图表示某些从属关系,下列选项正确的是( ) 用如图装置进行实验,将A逐滴加入B中:
用如图装置进行实验,将A逐滴加入B中: