题目内容
20.在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.20mol/L,c(Mg2+)=0.50mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为( )| A. | 0.15mol/L | B. | 0.10mol/L | C. | 0.50mol/L | D. | 0.20mol/L |
分析 设混合液中硫酸根离子的物质的量浓度为c,根据溶液中阴阳离子所带的正负电荷总数相等列式计算c值即可.
解答 解:设c(SO42-)=c,溶液中阴阳离子所带的正负电荷总数相等,
则:0.20mol•L-1×1+0.50mol•L-1×2=0.20mol•L-1×1+2c,
解得:c=0.50mol/L.
故选C.
点评 本题考查了物质的浓度的计算,题目难度不大,明确电荷守恒的含义及应用方法为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
相关题目
10.向KI、Na2S2O3、淀粉三种物质按一定比例组成的混合溶液中快速加入一定量的(NH4)2S2O8溶液并开始计时,ts时观察到溶液变蓝色,过程中发生下列反应:①2I-+S2O82-=I2+2SO42-(慢),②I2+2S2O32-=2I-+S4O62- (快)下列说法正确的是( )
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液一定显蓝色 | |
| C. | 若能观察都蓝色出现,刚起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 升高温度,①、②的反应速率均加快 |
11.一定条件下,可逆反应2A?B+3C,在下列四种状态中处于平衡状态的是( )
正反应速率 逆反应速率.
正反应速率 逆反应速率.
| A. | v(A)=2mol/(L•min) v(B)=2mol/(L•min) | |
| B. | v(A)=2mol/(L•min) v(C)=2mol/(L•min) | |
| C. | v(A)=1mol/(L•min) v(B)=2mol/(L•min) | |
| D. | v(A)=1mol/(L•min) v(C)=1.5mol/(L•min) |
8.下列实验方案不能达到预期目的是( )
| A. | 用Na、Mg分别与冷水反应来证明Na、Mg的金属性强弱 | |
| B. | 用同物质的量浓度的H2SO3酸性比H2CO3强,证明S的非金属性比C强 | |
| C. | 用HCl和HBr形成的难易程度,证明Cl的非金属性比Br强 | |
| D. | 用Cu、Mg分别与盐酸反应来证明Cu、Mg的金属性强弱 |
5.一定量的铁、镁和铜的混合物与一定量的浓HNO3恰好反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入2mol/L的NaOH溶液至Fe3+、Mg2+、Cu2+恰好沉淀,则消耗NaOH 溶液的体积是( )
| A. | 400 mL | B. | 200 mL | C. | 150 mL | D. | 80 mL |
12.我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题.关于锂的叙述不正确的是( )
| A. | 锂是较轻的金属 | B. | LiOH的碱性比NaOH弱 | ||
| C. | 锂的化学性质比钠活泼 | D. | 锂在空气中燃烧生成Li2O |
9. 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
(1)写出利用上述装置制备消毒液涉及反应的化学方程式4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O、Cl2+2NaOH═NaClO+NaCl+H2O.
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
获得结论:此实验小组制备的消毒液具有漂白性.
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:
取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟内不恢复.
②此消毒液有效氯含量为1.42%%.
 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
| 操作 | 现象 |
| a.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| b.向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去为探究操作a中溶液褪色的原因,又补充了如下实验:
| 操作 | 现象 |
| 取5mL pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
(3)该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降.
①操作b中溶液变成黄绿色的原因:2H++ClO-+Cl-═Cl2↑+H2O(用离子方程式表示).
②有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是取洗气瓶中溶液5mL,向其中逐滴加入硫酸,观察溶液是否逐渐变为黄绿色.
(4)有效氯的含量是检测含氯消毒剂消毒效果的重要指标.具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上.小组同学进行如下实验测定有效氯:
取此消毒液5g,加入20mL 0.5mol•L-1KI溶液,10mL 2mol•L-1的硫酸溶液;加几滴淀粉溶液后,用0.1mol•L-1Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O320mL.(已知:2S2O32-+I2═S4O62-+2I-)
①达到滴定终点时的实验现象是溶液蓝色褪去且半分钟内不恢复.
②此消毒液有效氯含量为1.42%%.
 .
.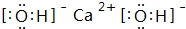 ,C的最高价氧化物的水化物化学式为:Al(OH)3.
,C的最高价氧化物的水化物化学式为:Al(OH)3. 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuSO4、Fe2(SO4)3、盐酸.按要求回答下列问题:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuSO4、Fe2(SO4)3、盐酸.按要求回答下列问题: